 设为首页
设为首页
 加入收藏
加入收藏
关于复分解反应的教学建议
复分解反应的教学要注意以下两点:
第一,让学生跟已学过的化合、分解、置换反应对比,找出复分解反应的特点,得出定义。
第二,及时巩固和运用。如表现盐酸化学性质的诸反应中,对于哪个属于复分解反应要及时予以指明,从而深入理解“相互交换成分”这句话的意义,并在学习稀硫酸化学性质和以后各节中随时加以复习。
关于几种常见的酸的教材分析
本节教材内容较多,讲述了四种常见酸的性质、用途,氯离子和硫酸根离子的检验方法,酸碱指示剂的显色和复分解反应概念等,内容虽多,教材写法是将盐酸作为重点展开。就内容编排来说,初步展示了研究酸类的化学性质时也可以有一个大致的顺序,即:酸分别跟指示剂、金属、金属氧化物、碱、盐等的反应,这就给下一步讲解稀硫酸的性质铺平了道路。讲硫酸时,分成稀硫酸和浓硫酸两部分。讲稀硫酸时重复用了认识盐酸性质的顺序。为总结酸的通性奠定了基础。讲浓硫酸突出了脱水性和吸水性。硝酸则突出它的腐蚀性和氧化性。对磷酸只点出它是一种常见的比较重要的酸。在讲盐酸和硫酸时,总是把用途和性质紧密结合,而性质又都从实验引出,使学生看得见,摸得着,层次清楚,重点分明。
关于硫酸的教学建议
硫酸的教学分为三部分进行。第一部分通过对浓硫酸的观察,使学生掌握它的物理性质;第二部分通过[实验8-12]和[实验8-13]让学生知道浓硫酸的特性及稀释时的注意事项;第三部分讲稀硫酸的化学性质。教材安排了四个实验,可仿照学习盐酸化学性质那样,列表把四个实验一次做完(随时记录实验现象),这样既学习了稀硫酸的化学性质,又对照复习了盐酸的性质,还为讲酸的通性作了准备,而且能适当地节约授课时间。
关于氯离子和硫酸根离子的检验
如果条件许可、时间充分,在讲完常见酸之后,可以增加氯离子和硫酸根离子的检验。但这一内容不作普遍要求。在讲解氯离子和硫酸根的检验时,还可增加碳酸钠溶液分别与硝酸银、氯化钡溶液的反应,沉淀生成后,再加稀硝酸使之溶解的实验。然后通过分析有关的化学方程式,以了解为什么在加硝酸银溶液检验氯离子时,还要加硝酸;加氯化钡溶液检验硫酸根离子时,要加硝酸的道理。
关于酸碱指示剂的教学建议
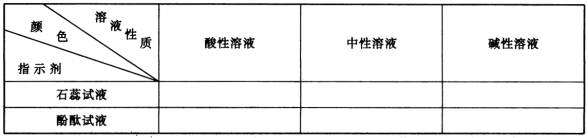
酸碱指示剂只介绍石蕊试液和酚酞试液两种,不宜再增加。教材中[实验8-7]氢氧化钠溶液使指示剂变色的实验,在讲盐酸化学性质时可以先不做,等讲完盐酸后再补做,使学生思路清楚,也突出盐酸和指示剂这两个重点。为了使学生牢记指示剂在酸碱溶液里显示的颜色,可列下表让学生填写:
关于硝酸的教学建议
硝酸的教学,可采用复习、归纳、预测、实验检验的方法。先通过观察使学生认识硝酸的物理性质,继之提出硝酸能电离出氢离子和硝酸根( ![]() ),与盐酸、稀硫酸对比,预测硝酸的性质,写出反应的化学方程式,然后再通过实验检验。一般来说学生在预测硝酸跟金属氧化物、跟碱、跟盐、跟酸碱指示剂的反应时是正确的。实验证明金属和硝酸反应并不产生氢气。在解释这个问题时,可以引导学生从盐酸、稀硫酸和硝酸的电离方程式来分析。三种酸电离时都产生氢离子,决定了它们有相同的化学性质(共性),但是它们的酸根不同,又决定了它们各有不同的性质(个性)。从而使学生逐步领会在给事物进行分类时,在识别其共性和个性时,要有一个辩证的观点。要使学生体会到规律是人们从实践中总结出来的。规律能指导人们去认识事物,但绝不能生搬硬套。同时,也使学生体会到,人的认识是否正确,要以实践来检验。例如,实验的结果表明硝酸跟金属反应一般不产生氢气。限于学生水平,教学不宜引伸。
),与盐酸、稀硫酸对比,预测硝酸的性质,写出反应的化学方程式,然后再通过实验检验。一般来说学生在预测硝酸跟金属氧化物、跟碱、跟盐、跟酸碱指示剂的反应时是正确的。实验证明金属和硝酸反应并不产生氢气。在解释这个问题时,可以引导学生从盐酸、稀硫酸和硝酸的电离方程式来分析。三种酸电离时都产生氢离子,决定了它们有相同的化学性质(共性),但是它们的酸根不同,又决定了它们各有不同的性质(个性)。从而使学生逐步领会在给事物进行分类时,在识别其共性和个性时,要有一个辩证的观点。要使学生体会到规律是人们从实践中总结出来的。规律能指导人们去认识事物,但绝不能生搬硬套。同时,也使学生体会到,人的认识是否正确,要以实践来检验。例如,实验的结果表明硝酸跟金属反应一般不产生氢气。限于学生水平,教学不宜引伸。
关于盐酸的教学建议
有关盐酸的教学是本节的一个重点,建议以实验带路。如条件允许,最好采取边实验、边讲解和讨论的方法,把观察到的实验现象提高到理性认识的水平。如打开盛盐酸的瓶盖,观察到有白雾出现时,可以向学生提出。“白雾是什么?它是怎样形成的?”“它能说明盐酸的什么性质?”等一连串问题。这不仅是讨论盐酸的性质,而且是在引导同学逐渐学会抓住那些稍纵即逝的现象去认识所观察的事物的本领。以上一系列问题的提出,可以使学生认识到盐酸是一种挥发性酸,它是氯化氢的水溶液,挥发出的氯化氢气体遇到空气中的水蒸气形成盐酸小液滴,白雾就是大量盐酸小液滴暂时聚集并悬浮在有限空间时出现的现象。它反映了氯化氢极易溶于水的性质,但也同样反映了盐酸极易挥发的性质。
有关盐酸化学性质的教学,可以列出如下表,边实验边讨论。每做一个实验,都要根据观察到的现象,分析产物、让学生自己写出反应的化学方程式。
要提醒同学,铁和盐酸反应生成氯化亚铁 ![]() ,铁是+2价(溶液呈淡绿色),铁锈
,铁是+2价(溶液呈淡绿色),铁锈 ![]() 和盐酸反应生成氯化铁
和盐酸反应生成氯化铁 ![]() ,铁是+3价(溶液呈黄色)。
,铁是+3价(溶液呈黄色)。
小结盐酸的物理、化学性质和用途后,再讲述酸碱指示剂和复分解反应两个概念,这样使讲课的思路条理清楚、重点突出,学生便于掌握。
演示实验建议
1.[实验8-6]石蕊试液用0.5%的水溶液,每10毫升盐酸滴加3~4滴;酚酞试液用0.5%酒精溶液,每10毫升盐酸滴加1~3滴。
2.[实验8-7]用1%的氢氧化钠溶液即可。
3.[实验8-8]和[实验8-9]用1:1的盐酸。
4.[实验8-10]在干净试管里倒入2~5毫升蒸馏水,再滴入几滴1:1的盐酸,便成稀盐酸,然后滴加0.5%的硝酸银溶液3~5滴,注意不要滴在试管壁上,观察发生的现象。在上述溶液里再滴加稀硝酸(1:2)3~5滴,振荡,观察,氯化银沉淀不溶解(长时间放置,氯化银变成灰色)。
5.稀硫酸的化学性质实验为1体积浓硫酸与5体积水配成的稀硫酸。
6.为了让学生对浓硫酸的密度有个感性认识,可以用三个相同的试剂瓶装上体积相同的水,让学生用手提起来,对比它们的分量,会有一个显然不同的直接感受,以此加深印象。
7.[实验8-14]锌、铁跟稀硫酸反应可以这样做:锌粒、铁屑放进试管后,倒入稀硫酸,反应进行一会儿,用燃着的火柴伸入试管口,会发出爆鸣声。如果用铁钉放入稀硫酸,反应速率太慢时,可先滴入几滴硫酸铜溶液,反应便会加快。