 设为首页
设为首页
 加入收藏
加入收藏
例1 下列盐酸的性质中,属于特理性质的是( )
A.盐酸可以使紫色石蕊试液变成红色
B.浓盐酸在空气里易挥发形成白雾
C.盐酸可以除去铁表面生成的铁锈
D.盐酸可以跟硝酸银溶液反应生成白色沉淀
分析:物理性质主要是指物质不发生化学变化所表现出来的性质,如:色(颜色)、态(状态)、味(气味)、硬(硬度)、密(密度)、度(溶解度)、熔(熔点)、沸点。当然,易挥发则属于沸点低。化学性质是指物质发生化学变化所表现出来的性质。也就是,有新物质生成时,所表现出来的性质。因此,此题中的(A)(C)(D)选项均属于有新物质生成表现出来的性质,当属化学性质。
解答:正确选项:应为(B)
点拨:熟练掌握盐酸,稀硫酸的物理性质和它们的化学性质对于下一节总结,归纳出酸类的通性十分必要,人们对事物的认识,都是从具体事物入手,从个别到一般。从实践上升为理论。大量的感性认识的积累才能上升为理性。
例2 一种无色有刺激性气味的气体,极易溶于水,其水溶液有下列性质:(1)可以使紫色石蕊试液变成红色。(2)取少量该溶液,加入一小段镁条后立即产生大量无色气体,该气体在空气中能够燃烧,火焰呈淡蓝色。(3)在该溶液中加入硝酸银溶液后,有不溶于稀硝酸的白色沉淀生成。根据上述实验现象判断,原无色气体是(写名称) ,水溶液的名称是 。写出上述(2)(3)实验中反应的化学方程式。
分析:此题为一实验推断题,所说的推断题,由实验现象入手,推断物质的成分从而确定该物质。因此,要熟悉实验现象。了解什么物质在什么情况下能发生如此现象。如加入硝酸银溶液后,会生成白色不溶于稀硝酸的沉淀,此沉淀就可以确定有 ![]() 。又如溶液可以使紫色石蕊变红,此溶液为酸性溶液,金属镁放入还能放出可燃性气体,此溶液应是一种酸。此酸又是由无色有刺激性气体溶于水形成的,当然,它是盐酸。学名:氢氯酸。
。又如溶液可以使紫色石蕊变红,此溶液为酸性溶液,金属镁放入还能放出可燃性气体,此溶液应是一种酸。此酸又是由无色有刺激性气体溶于水形成的,当然,它是盐酸。学名:氢氯酸。
解答:无色气体(写名称)氯化氢
水溶液的名称:氢氯酸。
化学反应方程式如下: ![]()
![]()
点拨:解好实验推断题,要十分了解酸、碱、盐的性质,还要熟习它们之间的相互反应关系。特别是,围绕着酸、碱、盐的有关实验,应动手实验,仔细观察实验现象,认真分析有关变化,透过现象看到本质,为了解好这类试题,大家应特别熟习的实验现象主要有;如:某气体通入澄清的石灰水,石灰水变浑浊。可知:在初中范围内,该气体为 ![]() 。又如,向某溶液中滴入稀硫酸产生不溶于稀
。又如,向某溶液中滴入稀硫酸产生不溶于稀 ![]() 的白色沉淀,此白色沉淀应为
的白色沉淀,此白色沉淀应为 ![]() 。原溶液中肯定含有
。原溶液中肯定含有 ![]() ,向某溶液中滴入
,向某溶液中滴入 ![]() ,产生不溶于稀
,产生不溶于稀 ![]() 的白色沉淀,此白色沉淀应为
的白色沉淀,此白色沉淀应为 ![]() 。原溶液中肯定含有
。原溶液中肯定含有 ![]() 。又如,向某蓝色溶液中滴加氢氧化钠溶液产生蓝色絮状沉淀,此沉淀为氢氧化铜。向某黄色溶液中滴加氢氧化钠溶液产生红褐色沉淀,此沉淀为氢氧化铁。熟悉以上这些实验现象,可以顺利地判断物质的组成和成分,有利于这类试题的解答。
。又如,向某蓝色溶液中滴加氢氧化钠溶液产生蓝色絮状沉淀,此沉淀为氢氧化铜。向某黄色溶液中滴加氢氧化钠溶液产生红褐色沉淀,此沉淀为氢氧化铁。熟悉以上这些实验现象,可以顺利地判断物质的组成和成分,有利于这类试题的解答。
例3 下列各式中,化学方程式正确的是( )
A. ![]()
B. ![]()
C. ![]()
D. ![]()
E. ![]()
分析:化学反应方程式能正确地表达反应物,生成物的成分参加或生成物质的化学式,组成物质的元素种类,分子内各原子个数之比,以及各物质质量的关系,因此,书写化学方程式要遵循两个原则:(-)要以事实为依据,它能正确地表达各物质之间的转化关系。(二)遵循质量守恒定律,也就是参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。为此,在化学反应前后,原子的种类不改变,原子的数目也没有改变,原子的质量也没有改变。因此,能正确表达上述定律,需将方程式两边化学式前系数加以配平。才算完整正确的化学反应方程式。(A)选项错误,因为Fe与盐酸反应只能生成二价的铁盐,不会生成三价铁盐。(B)选项错误,Al为三价金属,生成三价的铝盐。(C)选项错误, ![]() 与酸反应仍应生成三价铁盐而不能变为亚铁盐。正确的选项为(D)和(E)。
与酸反应仍应生成三价铁盐而不能变为亚铁盐。正确的选项为(D)和(E)。
解答:正确选项为:(D)、(E)
点拨:正确书写化学方程式要掌握以下几点:
(1)要熟习反应规律,参加反应,反应物的种类,生成物,生成物的种类。
(2)此类反应发生的条件和反应完成的条件。
(3)反应中元素化合价如何变化,应熟习。
(4)如何正确利用质量守恒定律,配平反应方程式。
例4 将56克铁、65克锌、27克铝分别与足量稀硫酸反应,生成氢气的质量比为( )
A.1:1:1 B.1:1:2 C.2:2:3 D.56:65:27
分析:利用金属与酸反应的化学反应方程式,可以将金属质量分别代入化学方程式求出所得氢气的质量,进而得到氢气的质量比。过程如下表示:设x、y、z分别为铁、锌、铝与酸反应生成 ![]() 的质量。
的质量。
![]()
56 2
56克 x
![]()
65 2
65克 y
![]()
2×27 6
27克 z
解得: ![]()
![]()
![]()
解答:正确选项:(C)
点拨:此题在认真分析了上述的正规的,按反应方程式计算步骤完成的氢气质量的计算中,可以得到如下的启示。每生成1克 ![]() 的质量分别为:铁为28克,锌为32.5克,铝为9克。酸为足量的情况下:
的质量分别为:铁为28克,锌为32.5克,铝为9克。酸为足量的情况下:
生成1克氢气所需金属的质量为= ![]() (克)
(克)
这样,上述金属生成 ![]() 的质量可直接导出:
的质量可直接导出:
![]()
![]()
![]()
氢气的质量比为:2:2:3。
例5 某金属的相对原子质量为A,它与稀硫酸发生置换反应时显正n价。现有0.5A克该金属与足量稀硫酸反应,放出氢气的质量为( )
A. ![]() 克
B.
克
B. ![]() 克
C.A克 D.n克
克
C.A克 D.n克
分析:关键问题是找到金属质量与生成 ![]() 质量的关系。一般解法:从化学反应方程式入手。
质量的关系。一般解法:从化学反应方程式入手。
金属显+n价,硫酸根显-2价,若金属用M来表示,则M的硫酸盐的化学式为:当n为奇数时为 ![]() ,当n为偶数时为
,当n为偶数时为 ![]() 。M与稀硫酸反应的化学方程式可以表示如下:
。M与稀硫酸反应的化学方程式可以表示如下:
![]()
![]()
金属与生成 ![]() 关系依然为:
关系依然为: ![]() ,比例关系:
,比例关系:
![]()
2A克 2n克
0.5A克 x
解得: ![]()
解答:正确选项:(B)
点拨:此题是用字母代替数字,但依然可以用例4的启示来求解;先求出生成1克 ![]() 所需该金属的质量:
所需该金属的质量:
![]() (生成1克
(生成1克 ![]() 所需金属质量)
所需金属质量)
则放出氢气的质量为 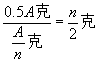
用此方法可以省去,对化学方程式的依赖。但它的导出,依然是以方程式为根据。同时,前题条件是:酸为足量。