 设为首页
设为首页
 加入收藏
加入收藏
复分解反应发生的条件
酸、碱、盐都是电解质,它们在溶液中的相互反应除去氧化-还原反应外(这部分内容将在高中学到),主要是指两种电解质溶液发生的复分解反应。将两种电解质溶液混合,实质是将它们电离所产生的各种阴、阳离子混合。如果没有不同种离子结合生成难溶于水的物质(即沉淀)从溶液中析出,也没有不同种离子结合生成气态物质从溶液中逸出,也没有不同种离子结合成难电离的物质(如水),那么这些离子只是共存于溶液中,实际没有生成新物质,当然就没有发生化学反应。例如将硝酸钾和硫酸钠两种盐溶液混合,溶液中主要有四种离子: ![]() 和
和 ![]() 。它们之间不能生成沉淀或气体或水,这四种离子共存于溶液中,没有生成新物质,可以得出硝酸钾溶液与硫酸钠溶液不能发生复分解反应的结论。
。它们之间不能生成沉淀或气体或水,这四种离子共存于溶液中,没有生成新物质,可以得出硝酸钾溶液与硫酸钠溶液不能发生复分解反应的结论。
将两种电解质溶液混合后,如果其中有两种离子结合生成沉淀物或结合生成气体或结合生成水,那么这两种离子被大量消耗生成了新物质,即发生了化学反应。例如将硝酸钡和硫酸钾两种盐溶液混合,溶液中的 ![]()
![]() 和 立即结合生成沉淀析出,溶液中的这两种离子大大减少,溶液中主要离子剩下两种:
和 立即结合生成沉淀析出,溶液中的这两种离子大大减少,溶液中主要离子剩下两种: ![]() 和
和 ![]() 。硝酸钡和硫酸钾溶液发生了化学反应,生成了
。硝酸钡和硫酸钾溶液发生了化学反应,生成了 ![]() 沉淀和
沉淀和 ![]() 溶液,即从原来的硝酸钡和硫酸钾两种化合物相互交换成分生成了硫酸钡和硝酸钾两种新的化合物。
溶液,即从原来的硝酸钡和硫酸钾两种化合物相互交换成分生成了硫酸钡和硝酸钾两种新的化合物。
根据上述分析,复分解反应发生的条件是有沉淀或气体或水生成。
酸、碱、盐之间的复分解反应,根据反应物种类的不同有酸与碱、酸与盐、碱与盐及盐与盐四种情况,它们发生复分解反应时对反应物的条件要求是不尽相同的。酸与碱的复分解反应(即中和反应)一般都能发生,特别是强酸(如盐酸、硫酸、硝酸)与强碱(如氢氧化钠、氢氧化钾、氢氧化钡)的反应,还有强酸与一般的碱或强碱与一般的酸的中和反应都可以发生,并且反应进行的程度比较彻底。碱与盐的复分解反应一般在碱、盐都溶于水,并且有沉淀生成时可以发生。盐与盐的复分解反应若能发生,要求两种盐都溶于水,且生成的盐中至少有一种是难溶于水的沉淀物。酸与盐的复分解反应情况较复杂,一般是强酸与弱酸的盐能发生反应。目前所学的内容中,酸与盐的复分解反应有两种情况可以发生:可溶性盐与酸反应生成不溶性盐,如:
![]()
![]()
![]() ,
,
![]()
![]()
![]() ;
;
还有碳酸盐与强酸反应放出二氧化碳,如:
![]()
![]()
![]() ,
,
![]()
![]()
![]() 。
。
氯气和盐酸的认识过程
舍勒虽然发现了氯气,也知道它的一些性质,究竟它是什么形态的气体,仍然没有清楚。这时法国化学家贝托雷继续研究氯气。他首先将氯气通入一个冷的空玻璃瓶里,让氯气里的含酸蒸气受冷凝结,再将除去酸蒸气的氯气依次通入三个盛满水的瓶使氯气溶于水。他发现溶有氯气的水溶液,在有光照的地方可以分解成盐酸和氧。贝托雷以此判断出氯气是盐酸和氧结合成的:氯=盐酸+氧
氯气是盐酸和氧结合得很松散的化合物,因此露置在阳光下就分解了。其实在当时人们已经用过许多强烈的药剂或其它手段来处理氯气,都未能使它分解为盐酸和氧。贝托雷的判断显然跟其它一些研究是矛盾的。他作出这个错误判断的主要原因,在于他忽视了水对氯气的作用。
1809年化学家盖·吕萨克和泰纳(Thenard,L.J.1777-1857),用分解法研究盐酸的组成。那时金属钾已被人们证明是一种元素。于是他们就用金属钾或铁等与盐酸气反应,看他是不是能够放出氯气。实验得出结果后,他们说:“我们考察金属钾对于盐酸气的反应。在寻常温度时,这个反应很慢;但钾熔时立刻燃于盐酸气中发光,结果得到氯化钾和氢。”
“在这个实验中收集的氢气之量,恰与钾和水接触时发生的相等。”
“我们在暗红热时,用盐酸气通过擦净的铁屑,许多氢气放出,而不觉有盐酸混合在内,同时得到氯化铁;残渣铁屑并没有氧化。”
“当中等温度时,用盐酸气通过既熔而又研成细粉的一氧化铅,又收集有氢,不过已与氧化合变成水的状态了。”
这个实验证明,不是氯气分解成盐酸和氧,而是盐酸分解成氯和氢。
在同一年盖·吕萨克和泰纳用合成法证明了盐酸的组成。他们把同量的氢气和氯气混合在一起,静置数日,或稍微加热,或露置日光中,都能化合成盐酸气。
这个实验有力地证明了盐酸气是氢气和氯气的化合物,而且是这两种气体化合而成的唯一物质,其变化应该表示为:氯+氢=盐酸气
盖·吕萨克和泰纳的实验,对盐酸的组成作出了正确的结论,但是氯气在他们的眼里仍然是一种化合物。因为法国的化学家拉瓦锡,在提出燃烧的氧化理论的时候,也提出了“氧是成酸元素”的论点,认为一切酸的成分都有氧,这个观点深深地印在广大化学家的脑子里。盖·吕萨克和泰纳是深信这个论点的,因而他们也认为氯是某种“基”的氧化物。既然氯气是某种基的氧化物,那么盐酸就应该是某种基跟氧和氢的化合物:盐酸=X(某种基)+氧+氢
为了寻找氯气中的氧,化学家们想尽各种办法,诸如利用金属、红热木炭、磷或其它吸氧剂,都没有从氯气中分解出氧来。1810年英国的年轻化学家戴维(Davy,S.H.1778-1829),曾用干电池将木炭烧至白热,仍没有使氯气分解。经过这些失败,引起了戴维对氯气中含有氧的说法产生了怀疑。他重做盖·吕萨克和泰纳合成盐酸的实验,并证实氯和氢化合成盐酸的结论是正确的,除了稍有水的痕迹外,没有其它杂质。实验既没有发现氯气或盐酸中有氧存在,为什么我们硬要说它有氧存在呢。他感到只有认为氯是一种元素,那么有关氯的所有实验才能得到合理的解释。在这年的11月,戴维在英国皇家学会宣读了他的论文,正式提出氯是一种元素。以后,化学发展的新事实也都充分证实了戴维这一结论的正确性。关于拉瓦锡提出一切酸都含有氧的论点,也得到了纠正。
硝酸
纯硝酸是无色、易挥发、有刺激性气味的液体。硝酸与水互溶,浓硝酸一般在14mol/L以上,稀硝酸一般在6mol/L以下。浓硝酸常带黄色,因为分解出的棕色NO2溶入酸内。硝酸开盖后又酸雾逸出,这是因为放出的硝酸蒸汽与空气里的水蒸气成了极微小的硝酸液滴,所以叫发烟硝酸。

化学性质
硝酸是强非金属--氮的高价氧化物的水化物。硝酸是一种强酸,具有酸的通性,不过因为它的氧化性很强,与金属置不出氢气,得到的是氮的氧化物和水。硝酸种的氮为+5价,它是氮的最高价态,导致硝酸有强氧化性。浓硝酸与还原反应的还原产物一般是二氧化碳,稀硝酸与还原剂反应的还原产物一般是一氧化氮。硝酸不稳定,易于光,热作用下分解。有强腐蚀性,对金属,生物体,橡胶等腐蚀严重。
制法
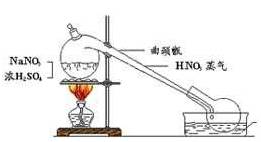
实验室里制少量硝酸可以用硝酸钠与浓硫酸的供热反应,既不挥发酸制取挥发酸。注意
1、只能微热使生成硫酸氢钠和硝酸,因为硝酸受强热会大量分解。
2、加热需适用曲径甑。
3、挥发出来的硝酸蒸汽用被水冷却的圆底烧瓶收集。
4、浓硫酸和晶体硝酸钠反应,所制的的是几乎无水的浓硫酸。
酸中之王——超强酸
硫酸、盐酸、硝酸,统称为“三酸”,大家已比较熟悉。这些酸具有一个共同特点—强腐蚀性。浓盐酸和无水氯化锌按适当比例混合,可作为手工锡焊铁制品的清洗剂。金子的抗腐蚀性能是极强的。纯金埋入泥土中,即使是经过几百年、几千年也无明显锈蚀,但把金子放入一份体积的浓硝酸和三份体积的浓盐酸混合成的液体—王水之中,也会逐渐溶解。当然,如果不小心,将这些酸滴到人的皮肤或衣物上,就会产生严重的烧伤和腐蚀。
近年来,科学家开发和研制了比硫酸、盐酸、硝酸的酸性强几百万倍,甚至几十亿倍的所谓超强酸。这些超强酸酸性极强。以 ![]() 为例,当摩尔比为1:0.03的酸性强度,要比100%硫酸的强度约大一亿倍。某些超强酸,如魔酸等,目前市场上已有商品出售。
为例,当摩尔比为1:0.03的酸性强度,要比100%硫酸的强度约大一亿倍。某些超强酸,如魔酸等,目前市场上已有商品出售。
别看超强酸的酸性和腐蚀性强得出奇,但它们在化学和化学工业方面却是极有价值的物质。超强酸既是无机及有机化合物的质子化试剂,又是活性极高的酸性催化剂。过去有不少化学反应是极难实现或根本无法实现的。但在超强酸环境中,却能异常顺利地完成。
可以预料,超强酸必将在化学工业中发挥越来越多的作用。