 设为首页
设为首页
 加入收藏
加入收藏
教材分析
在新教材中第二节安排的内容是二氧化硫,把硫化氢作为第一节氧族元素后的选学内容了。重点突出。本节是典型的元素化合物知识,同时与生活、环境紧密相连。学生在此之前已经学习过典型的非金属元素卤族,典型的金属元素碱金属,同时又有元素周期律和元素周期表知识作为指导,学习起来应该不会很困难。
本节主要介绍二氧化硫的物理、化学性质及其危害。在讲述二氧化硫的溶解性时,增加了演示实验,既说明它可以溶于水,同时通过石蕊试液变红说明溶于水后生成了酸,从而很容易地引入它的化学性质,首先,它应具有酸性氧化物的通性。然后结合二氧化硫可以和氧气反应复习可逆反应和氧化还原反应的有关知识。通过分析二氧化硫中硫元素的化合价,得出它应既具有氧化性,又具有还原性。
二氧化硫的漂白性关键是做好演示实验,由性质引出用途。
二氧化硫是污染大气的主要有害物质之一,又是造成酸雨的罪魁祸首。学习二氧化硫的性质,不能不把它所造成的污染问题认真对待。这部分知识与第四节环境保护会有一定联系,因此在教学中,要做好铺垫。
本节教学重点:二氧化硫的化学性质;对二氧化硫的性质的认识。
难点:二氧化硫在不同环境下表现出性质的多重性。
教法建议
二氧化硫在高中化学教材中占有特殊重要的位置,主要表现在以下几点:
1.二氧化硫与当今世界的发展问题、环境问题有着密切联系。在中学化学的教学内容里,二氧化硫的性质及其与人类生活的关系是一个重要的、不可能回避的问题。在教学中,可以以此为契机,开展研究,目的是将课堂上或书本中的知识运用于实际,培养信息处理的能力,合作学习的能力,分析问题的综合能力,表达能力和社会责任感。具体建议如下:
(1)面向全体学生提出以下问题:
①二氧化硫造成污染及其防治的化学原理;
②本地二氧化硫污染成因分析;
③防治建议(化学的、工业的、社会的角度)。
(2)布置任务
①文献收集:学生查询有关资料,资料来源可以使多渠道的,例如计算机网络、图书馆、教科书、报刊杂志、广播电视报道、空气质量报告,也可以就此问题进行专家访谈等。
②综述与分析:对所得资料进行分类整理,提炼出主要数据、主要观点或主张;对这些数据和观点进行科学分析,整理成《文献综述》。
③在文献研究的基础上,出自己的观点(研究成果),并对其进行论证。然后将研究成果以一定的形式表达出来,可以是论文、小报、展板、调查报告等。
(3)按照自愿结合的原则,将学生分成若干小组,每个小组5-7人,选出组长,小组成员要有明确分工。
(4)组织表达与交流活动
根据学生成果形式,组织全班交流活动。交流以组为单位进行,每个小组选出代表,向全体师生介绍研究过程与成果。如果条件允许的话,应为学生准备适当条件(例如多媒体系统、实验仪器与药品、相关软件等)。教师和其他学生对汇报的内容、形式、成果做出评价,评价以鼓励和肯定为主。
2.学生已经学习了典型的金属元素——碱金属和典型的非金属元素——卤素。在此基础上,又学习了物质结构、元素周期律、化学键和分子结构等理论知识。二氧化硫是结构理论后学生学习的第一种物质,在教学思路上,应该从“从个别到一般”的归纳法,过渡到“从一般到个别”的演绎法。也就是说二氧化硫的学习应该成为理论指导下的学习。
具体建议是,(1)将硫元素放在元素周期表中进行分析,通过与其他元素的比较来认识具体物质:
| ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| N |
O |
F |
||
| P |
S |
Cl |
||
| As |
Se |
Br |
(2)将本章 第一节 氧族元素 作为学习的基础。
3.在本章教材内容里,关于硫元素的化合物只介绍两种——二氧化硫、硫酸。这两种物质的教学,应该足以支撑学生对硫元素的总体认识。通过二氧化硫和硫酸的教学,应该使学生建立“硫元素系统”的整体印象。
| 价态 |
-2 |
0 |
+1 |
+4 |
+6 |
|
示例 |
H2S |
S2 |
FeS2 |
SO2 |
SO3 |
| Na2S |
S4 |
H2SO3 |
H2SO4 |
||
| Ag2S |
S6 |
Na2SO3 |
CaSO4 |
||
| CuS |
S8 |
BaSO4 |
4.中学所学理论(例如物质结构理论)内容浅显,远不足以满足对元素化合物性质的解释需要。因此在教学中应该注意规律的应用,例如氧化还原反应规律、复分解反应规律、物质的分类与通性等等。
对二氧化硫而言:从物质分类的角度来分析,二氧化硫试酸性氧化物,具有酸性氧化物的性质: SO2+2NaOH=Na2SO3+H2O;CaO+SO2=CaSO3;H2O+SO2=H2SO3。从氧化还原的角度来分析,二氧化硫中的硫元素处于“中间价态”,与强氧化剂反应是可以被氧化为+6价,在水溶液中通常以SO42-的形式存在,干态时可以以SO3的形式存在;与强还原剂反应时,可以被还原为0价,通常以单质的形式存在。从物质的特殊性角度来分析,二氧化硫具有以下性质:①毒性(其毒性不如硫化氢强);②漂白性。二氧化硫的漂白机理与次氯酸有所不同。次氯酸的漂白作用是利用其强烈的氧化性,将有色物质的分子破坏掉,变为无色的物质。这个反应通常进行的比较完全,且为不可逆过程;二氧化硫的漂白作用是二氧化硫、水和有色物质发生化合反应生成无色物质,一般来说这种无色物质不稳定,受热或者长时间放置会将二氧化硫重新放出,使被漂白的物质恢复原来的颜色,二氧化硫的漂白作用是一个可逆的过程。由于次氯酸具有较强的氧化性,容易
毁坏被漂白的物质,因此在实际生活中,二氧化硫的漂白作用比次氯酸应用的场合多。
5.二氧化硫具有多方面多层次的性质,是知识系统和链条中的“关节点”,应用简单仪器就可以对其进行多方面的探索与研究。
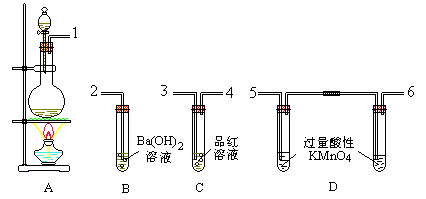
建议师生一起设计一个联合装置,一次性地展现二氧化硫的主要性质(酸性、氧化性、还原性、漂白性)并防止污染教室内的空气。
下述装置供参考:
6.针对传统教学中忽视学生主体性和创新精神、实践能力培养的弊端,国家提出关于开展研究性学习的要求,并以独立的课程形式出现在《课程计划》当中,规定了相应的课时。这对新理念新模式的引入无疑是一个有力的推动。但是只有教师能够在学科的课堂教学中贯彻这样的理念,实践这样的模式,问题才能真正的以解决。因此,教师应在学科教学中,不失时机地实施研究性学习的实践。围绕二氧化硫的性质可以在思维层面和实验层面进行多角度多层次的设计。因此,二氧化硫的教学为开展探究性的学习提供了不可多得的素材。在学科教学中实施研究性学习,要与教学目标和任务紧密结合起来,活动的安排要与学生的水平和兴趣相一致。