 设为首页
设为首页
 加入收藏
加入收藏
例1 把氯化铝溶液蒸干灼烧,最后得到的主要固体产物是什么?在氯化铝溶液中分别加入 ![]() 和
和 ![]() 溶液时,所得产物有哪些?写出有关化学方程式或离子方程式。
溶液时,所得产物有哪些?写出有关化学方程式或离子方程式。
分析 氯化铝是个弱碱强酸盐,能发生水解反应,这一水解反应的化学方程式是:
![]()
![]()
![]()
盐类水解反应是个吸热反应,当升高温度时,依平衡移动原理,反应再向水解方向移动,按照题意“蒸干灼烧”时,将会使 ![]() 挥发,并使
挥发,并使 ![]() 分解,变为
分解,变为 ![]() 。
。
把 ![]() 溶液与
溶液与 ![]() 溶液混合时,并不是发生两种盐的复分解反应,这是因为
溶液混合时,并不是发生两种盐的复分解反应,这是因为 ![]() 是弱碱强酸盐,容易发生水解反应:
是弱碱强酸盐,容易发生水解反应:
![]()
![]()
![]()
其水溶液呈现酸性; ![]() 是弱碱强酸盐,同样容易发生水解反应:
是弱碱强酸盐,同样容易发生水解反应:
![]()
![]()
![]() (一步水解)
(一步水解)
![]()
![]()
![]() (二步水解)
(二步水解)
其水溶液呈现碱性。当两种溶液混合时, ![]() 水解产生的
水解产生的 ![]() 与
与 ![]() 水解产生的
水解产生的 ![]() 相互反应,使上述两个反应均向正反应方向移动,产生
相互反应,使上述两个反应均向正反应方向移动,产生 ![]() 沉淀和
沉淀和 ![]() 气。
气。
把 ![]() 溶液与
溶液与 ![]() 溶液混合,同样发生类似的反应,其产物是
溶液混合,同样发生类似的反应,其产物是 ![]() 沉淀和
沉淀和 ![]() 气体。
气体。
解答 把 ![]() 溶液蒸干得到的固体是
溶液蒸干得到的固体是 ![]()
![]()
![]()
![]()
继续灼烧时, ![]() 分解为
分解为 ![]()
![]()
![]()
![]()
![]() 溶液与
溶液与 ![]() 溶液混合,产生
溶液混合,产生 ![]() 沉淀和
沉淀和 ![]() 气(另有
气(另有 ![]() 生成)
生成)
![]()
![]() 溶液与
溶液与 ![]() 溶液混合,产生
溶液混合,产生 ![]() 沉淀和
沉淀和 ![]() 气(另有
气(另有 ![]() 生成)
生成)
![]()
例2 氯化铵晶体溶于重水中,溶液呈现酸性,下列叙述的原因正确的是( )
(A) ![]() 水解生成
水解生成 ![]() 和
和 ![]()
(B) ![]() 水解生成
水解生成 ![]() 和
和 ![]()
(C) ![]() 水解生成
水解生成 ![]() 和
和 ![]()
(D) ![]() 水解生成
水解生成 ![]() 和
和 ![]()
分析 氯化铵是弱碱强酸盐,溶于水中时,
![]() 水解时溶液呈现酸性,在本题题干中给出
水解时溶液呈现酸性,在本题题干中给出 ![]() 溶于重水中,溶液呈现酸性,是
溶于重水中,溶液呈现酸性,是 ![]() 使
使 ![]() 的电离平衡向正方向移动的结果,其水解的过程式如下:
的电离平衡向正方向移动的结果,其水解的过程式如下:
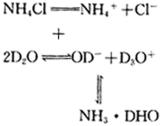
水解的实质是 ![]() 与
与 ![]() 电离出来的
电离出来的 ![]() 结合生成
结合生成 ![]() ,使
,使 ![]() 的浓度不断增大,直至达到平衡,溶液呈现酸性。
的浓度不断增大,直至达到平衡,溶液呈现酸性。 ![]() 在
在 ![]() 中发生水解反应的离子方程式是:
中发生水解反应的离子方程式是:
![]()
![]()
![]()
解答:D
点拨 理解盐的水解实质,在于
![]() 与重水(
与重水( ![]() )电离出来的
)电离出来的 ![]() 结合为
结合为 ![]() ,并生成
,并生成 ![]() (即
(即 ![]() ),是正确回答本题的关键。
),是正确回答本题的关键。
例3 在下列各微粒中,能使水的电离平衡向正方向移动,而且溶液的pH大于7的是( )
![]()
分析 选项A的微粒是 ![]() ,选项D的微粒是
,选项D的微粒是 ![]() ,是思考本题必须明确的重要前提。
,是思考本题必须明确的重要前提。 ![]() 虽使水的电离平衡向正方向移动,但是溶液呈现酸性,因而不合题意;
虽使水的电离平衡向正方向移动,但是溶液呈现酸性,因而不合题意; ![]() 是弱酸根离子,可与
是弱酸根离子,可与 ![]() 电离出来的
电离出来的 ![]() 结合为
结合为 ![]() ,使水的电离平衡向正方向移动,并且使溶液呈现碱性,
,使水的电离平衡向正方向移动,并且使溶液呈现碱性, ![]() 水解的离子方程式是:
水解的离子方程式是: ![]()
![]()
![]() ,因此,选项B符合题意;
,因此,选项B符合题意; ![]() 提供的
提供的 ![]() 使水的电离平衡向逆方向移动,而且溶液呈酸性,选项C不合题意;
使水的电离平衡向逆方向移动,而且溶液呈酸性,选项C不合题意; ![]() 是弱酸根阴离子,可与
是弱酸根阴离子,可与 ![]() 电离出来的
电离出来的 ![]() 结合成弱电解质
结合成弱电解质 ![]() ,使水的电离平衡向正方向移动,并且使溶液呈现碱性,
,使水的电离平衡向正方向移动,并且使溶液呈现碱性, ![]() 水解的离子方程式是:
水解的离子方程式是: ![]()
![]()
![]() ,因此,选项D同样符合题意。
,因此,选项D同样符合题意。
解答:B、D
点拨 ![]() 和
和 ![]() 都是酸式酸根离子,
都是酸式酸根离子, ![]() 是弱酸的酸式酸根离子,能发生水解反应,并使溶液呈现碱性,
是弱酸的酸式酸根离子,能发生水解反应,并使溶液呈现碱性, ![]() 是强酸的酸式酸根离子,不能发生水解反应,只能电离出
是强酸的酸式酸根离子,不能发生水解反应,只能电离出 ![]() 和
和 ![]() ,是本题给我们的重要启示。
,是本题给我们的重要启示。