 设为首页
设为首页
 加入收藏
加入收藏
教材分析
教材主要分成两部分:硫酸和硫酸根离子的检验。与旧教材相比,新教材中把硫酸盐作为选学内容,突出本节的重点内容。
由于学生在初中已经接触过硫酸,学过稀硫酸的性质。因此教材开始以旧知识引入。硫酸是强电解质,复习稀硫酸的性质。然后转而讨论硫酸除了具有酸的通性外还有一些特性。纯硫酸、浓硫酸、稀硫酸,其中溶质质量分数由大变小的量变,造成溶液中粒子的质的变化。
硫酸既具有酸的通性,又具有一定的特性。稀硫酸主要显示酸性;而浓硫酸还具有吸水性、脱水性和强氧化性。但是不是说只有浓硫酸才具有氧化性,稀硫酸也有氧化性,只是比较弱,体现在氢离子上。
浓硫酸的吸水性和脱水性是不同的两个概念。关于吸水性,学生初三已经学过。因此教材主要介绍了脱水性,并通过实验加以说明。
浓硫酸的氧化性是本节的重点内容,也是一个难点。教材通过实验让学生观察,然后得出结论。根据反应产生的气体能使蓝色石蕊试液变红和能使品红溶液褪色,学生可以很快推知这种气体是二氧化硫,由此说明浓硫酸跟金属反应一般不放出氢气,此反应属于氧化还原反应。然后再根据稀释后溶液为蓝色,推知此反应生成了硫酸铜。这样学生可以自己完成反应的化学方程式。分析反应前后元素化合价的变化,可以很容易得出浓硫酸具有强氧化性的结论。这样通过学生观察实验,分析实验现象,得出结论的方式获得知识。符合学生的认知规律,很好的结合了学过的知识,而且有进一步的提高。
关于硫酸的用途,教材通过图示的形式简单明了的给出,教师可以让学生结合硫酸的性质讨论归纳出用途。此外教师也可以适当补充我国硫酸工业发展的现状等资料,与生产实际结合起来。
关于硫酸根离子检验这一部分,教材采取复习已有知识、观察实验、记录现象、分析原因、得出结论。
本节安排了硫酸盐的选学内容。
本节教学重点:浓硫酸的性质和硫酸根离子的检验。
难点:浓硫酸的氧化性。
硫酸物理性质的教学建议
可以采取展示实物,让学生自己探索并总结得出物质的物理性质。例如:
展示:浓硫酸(半瓶)。
让一学生振荡试剂瓶并描述:油状液体。
演示:托盘天平一边放上述浓硫酸,另一边放半瓶浓盐酸(容积相同)。
学生描述:硫酸密度大。
演示:分别打开浓硫酸和浓盐酸的瓶塞,并轻微振荡。
学生描述:硫酸难挥发(与浓盐酸相比较得出)。
演示:向盛有水的烧杯中慢慢加入浓硫酸并不断搅拌。
学生描述:硫酸能以任意比与水混溶,并放出大量的热。
这样做,学生精力集中,兴趣盎然,思维积极活跃。这实际上给学生设置了“发现”的情境,即学生通过探索发现了硫酸的物理性质,其印象深刻。
关于酸的几个常见问题
学生从初中接触化学以来了解了很多关于酸的性质。容易在学习过程中产生问题,例如:对于酸的氧化性和氧化性酸区分不开、酸性强弱的判断不明确等。教师应该及时引导学生进行小结。本节正好结合硫酸的内容,把相关知识进行辨析。
一、氧化性酸和酸的氧化性
氧化性酸是指酸根具有氧化性。例如:浓硫酸(H2SO4)、硝酸(HNO3)、高锰酸(HMnO4)、重铬酸(H2Cr2O7)、次氯酸(HClO)等。
任何酸的水溶液能电离出H+而具有弱氧化性,因而可溶性酸都有氧化性。
二、挥发性酸与不挥发性酸
挥发性酸:盐酸、氢溴酸、硝酸、氢硫酸、亚硫酸
不挥发性酸:硫酸、磷酸、硅酸
三、酸性强弱的判断:
强酸:HClO4、HI、HNO3、HCl、H2SO4
中强酸:H2SO3>
H3PO4>HNO2
弱酸:HF>CH3COOH
> H2CO3 >
H2S > HClO > HCN >
H2SiO3
四、酸酐
无机物中酸酐皆为酸性氧化物,如N2O5、SO3等。
浓硫酸 和 稀硫酸
稀硫酸是硫酸的稀水溶液,其主要成分是 ![]() 、
、 ![]() 和
和 ![]() 。浓硫酸中水较少,硫酸只有部分电离,大部分仍然以硫酸分子的形式存在。
。浓硫酸中水较少,硫酸只有部分电离,大部分仍然以硫酸分子的形式存在。
稀硫酸的氧化性是由 ![]() 所体现,呈现弱氧化性。浓硫酸的氧化性由硫酸分子中+6价的硫元素所体现,有强氧化性。同样基于浓稀硫酸组成的不同,浓硫酸表现出稀硫酸所没有的吸水性、脱水性。
所体现,呈现弱氧化性。浓硫酸的氧化性由硫酸分子中+6价的硫元素所体现,有强氧化性。同样基于浓稀硫酸组成的不同,浓硫酸表现出稀硫酸所没有的吸水性、脱水性。
浓硫酸的氧化性是指硫酸分子中+6价的硫的氧化性,而不是氢离子的氧化性。因此浓硫酸在反应中是否体现氧化性看+6价的硫的化合价是否降低。
浓硫酸体现酸性是提供氢离子的性质,多数情况生成水。但不能把反应中有无水生成作为浓硫酸是否表现酸性的唯一标志。
![]()
![]()
![]()
该反应中尽管有水生成,但浓硫酸表现的是氧化性,而不是酸性。由于浓硫酸在反应过程中如提供氢离子,必然有
![]() 生成。所以生成物中有无
生成。所以生成物中有无
![]() ,可用来判断浓硫酸是否在反应中表现酸性。如:
,可用来判断浓硫酸是否在反应中表现酸性。如:
![]()
反应中浓硫酸既表现酸性又表现氧化性,在下述反应中浓硫酸只表现氧化性。
![]()
![]()
![]()
铜和浓硫酸反应实验的改进
改进实验法一
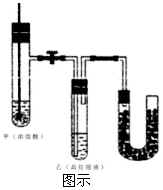
一、实验用品: 带支管的试管、铁架台、铁夹、酒精灯、试管、U形管、玻璃导管、橡皮塞、止水夹和胶头滴管。
浓硫酸、细铜丝、粗铜丝、品红溶液、玻璃纤维、炭黑和消石灰。
二、实验步骤
1. 取适当大小的橡皮塞一个,用粘有少量凡士林的粗钢丝穿透橡皮塞使之能在橡皮塞中上下移动、在钢丝的下端绑上适量细铜丝。
2.把少量玻璃丝放入U形管,再加入适量的消石灰和活性炭,继续放入玻璃丝,再放入消石灰和活性炭,如此反复直至装满U形管。注意应保持U形管中物质的疏松,便于气体流通。
3. 按图示连接好装置,并检查装置的气密性。
4.在各试管中加入相应药品,连接好装置。使止水夹处于开启状态,注意不要把细铜丝伸入浓硫酸中。
5.加热浓硫酸至沸腾时,将粗钢丝伸入浓硫酸中,使细铜丝完全浸入浓硫酸。三分钟左右后停止加热,并将细铜丝往上提。倘若品红溶液倒流,要关闭止水夹。
6.待稍冷却,用胶头滴管吸去试管甲中的上层液体。向试管中加入4至5毫升水
三、实验现象:
开始时试管甲中有大量的白雾生成。这是因为二氧化硫与水结合成亚硫酸小液滴的缘故、钢丝表面变黑,随着反应的继续进行,黑色物质消失,溶液逐渐浑浊;
乙试管中品红溶液逐渐褪色;停止加热后,试管甲的底部有大量白色的晶体析出,往其中加适量的蒸馏水。
四、心得体会:
1.时间短,效率高。 由于采用细铜丝,反应速度较快。
时间只需2—3分钟、 细铜丝可以继续使用。且在以后检验生成物硫酸铜的实验中便于观察。
2.无污染。本实验利用了防毒面具的原理、在装置中接入U形管,
内装活性炭、玻璃丝和消石灰。
3.反应充分,现象明显。请看如下对比实验:分别用烧瓶隔着石棉网加热和试管直接加热,结果表明,隔着石棉网加热的时间长,副反应产生的黑色固体多,在试管中加热反应时间短,黑色固体少。可见,加热温度越高,实验现象越明显、效果越好。本实验硫酸过量,在试管中加热,反应充分,生成了较多的白色硫酸铜固体,且由于副产物黑色固体少,
向其中加入少量水可观察到美丽的蓝色溶液,现象明显。
改进实验法二:
在试管中加入一块铜片,注入少量浓硫酸,加热片刻。在试管口的湿润的蓝色石蕊试纸变红(SO2生成),未反应完的铜表面黑色的不溶物,试管底部还有少量的灰黑色的沉淀;将试管内的溶液倒入另一支盛有水的试管中很难观察到溶液变蓝。其实那黑色的物质是CuS、Cu2S等硫化物,灰黑色的沉淀是CuS、Cu2S等与CuSO4的混合物。整个反应是在非水溶液中进行的,反应过程中生成的少量的水以水蒸气释放出,生成的CuSO4几乎没有水溶解而以白色沉淀出在试管中。反应后试管中的溶液几乎都是浓H2SO4
,被倒出稀释的是H2SO4
而不是CuSO4溶液,故很难观察到溶液变蓝。为了能明显地观察到实验现象,而且再实验中不使之产生黑色物质,将此实验作了小小的改动。具体操作和现象如下:
1.(1)预先将一片湿润的蓝色石蕊试纸贴在玻璃棒上备用;
(2)将一根铜制的导线剥去塑料包皮后露出铜丝(约7—8厘米);取一支滴管,剥去胶头将导线伸进滴管,使铜丝在尖嘴的一端露出;
2. 在 一支试管中加入少量浓H2SO4
,固定在铁架台上,用酒精灯加热至接近沸腾。
3. 实验时手持滴管,使铜丝露出的一端伸进预先加热的浓硫酸中,同时将贴有试纸的玻璃棒靠近试管口。待湿润的石蕊试纸变红时取出铜丝。静置片刻,在试管底部可以观察到有白色沉淀(即无水CuSO4)生成。冷却后,弃掉上层液体,往试管中加入少量水,白色沉淀溶解得到蓝色溶液,效果甚好。
抓住特性讲好浓硫酸性质
浓硫酸是无色油状液体,密度 ![]() ,沸点388℃,是一难挥发性的强酸。利用浓硫酸的难挥发性,可制取硝酸和氢氟酸
,沸点388℃,是一难挥发性的强酸。利用浓硫酸的难挥发性,可制取硝酸和氢氟酸
![]()
![]()
![]()
![]()
![]()
![]()
浓硫酸除具有一般酸的通性外,还具有以下特性:
(1)吸水性 浓硫酸能吸收湿存水和气体中的水分,是常用的气体干燥剂
![]()
![]()
![]()
(2)脱水性 浓硫酸能把有机物分子中的 ![]() 和
和 ![]() 以
以 ![]() 的形式脱去。例如:
的形式脱去。例如:
![]()
脱水性与吸水性有着本质差异,属于化学变化。
(3)氧化性 在硫酸分子中硫元素为+6价,处于硫的最高价态,当遇还原剂时,+6价的硫可还原为+4价的硫
![]() ,表现出浓硫酸的强氧化性。例如:
,表现出浓硫酸的强氧化性。例如:
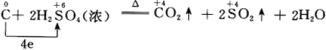
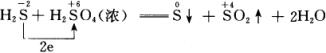
又如:
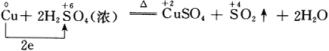
![]()
![]()
![]()
在浓硫酸与金属的反应中,作为氧化剂的硫酸分子得到2个电子,还原为二氧化硫分子;而生成金属硫酸盐所耗用的硫酸,硫元素的化合价在反应前后没有发生变化,显现出硫酸的酸性。从化学方程式可以看出,作为氧化剂耗用的硫酸与作为酸耗用的硫酸的物质的量,在上述两个化学反应中恰好相等。