 设为首页
设为首页
 加入收藏
加入收藏
课题:第一节 元素周期表
第一课时
教学目标:
知识目标:
1.使学生了解元素周期表的结构以及周期、族等概念。
2.使学生理解同周期、同主族元素性质的递变规律,并能运用原子结构理论解释这些递变规律。
3.使学生了解原子结构、元素性质及该元素在周期表中的位置三者之间的关系,初步学会运用周期表。
能力目标:
通过对元素原子结构,位置间的关系的推导,增强学生的分析和推理能力。
情感目标:
1.加深学生对物质世界对立统一规律的认识。
2.辩证唯物主义量变质变的观点,在本节内容中有具体的体现。
3.对学生进行爱国主义教育。
教学重点:元素周期表的结构,元素的性质、在表中的位置、与原子结构的关系。
难点:元素的性质、在表中的位置、与原子结构的关系。
教学过程:
引入:元素周期律揭示了元素的性质随着原子序数的递增而呈周期性变化。那么,我们能否用一种表格的形式揭示周期律呢?引出课题—元素周期表
播放动画元素周期律中“周期律的表现形式”的内容。
简述:门捷列夫与元素周期表
讲解:1.排布原则
(1)按原子序数递增的顺序从左到右排列。
(2)将电子层数相同的元素排成一个横排。
(3)把最外层电子数相同的元素(个别例外)按电子层数递增的顺序从上到下排成纵行。
板书:一、元素周期表的结构
学生观察周期表,教师讲解有关知识。
认识周期表的结构(7个周期、16个族)(学生看着周期表,师生同时探讨此问题)
(1)横:“三短、三长、一不全 ,镧系、锕系列下边”
三个短周期、三个长周期、一个不完全周期。
(2)纵: “七主七副八与零,镧系锕系挤当中”
七个主族、七个副族、一个第八族、一个零族;镧系锕系元素全部挤在第三纵行即第三副族当中)。
七个主族:由短周期和长周期元素共同构成的族(一A族~七A族)
七个副族:仅由长周期元素组成的族(一B族~七B族)。
第八族:三个纵行(Fe、Co、Ni等9种元素)
零族:稀有气体元素。
板书:二、同周期、同主族元素性质的递变规律
展示:ppt文件
|
项目 |
同周期(左 - 右) |
同主族(上- 下 ) |
|
|
原子结构 |
核电荷数 |
逐渐增大 |
增大 |
|
电子层数 |
相同 |
增多 |
|
|
原子半径 |
逐渐减小 |
逐渐增大 |
|
|
性质 |
化合价 |
最高正价由+1至+7, 负价数=--(8-族序) |
最高正价、负价数相同 最高正价=族序数 |
|
元素的金属星 和非金属性 |
金属性逐渐减弱,非金属性逐渐增强 |
金属性逐渐增强,非金属性逐渐减弱 |
|
|
单质的氧化性、还原性 |
还原性减弱、氧化性增强 |
氧化性减弱,还原性增强 |
|
|
最高价氧化物对应的水化物的酸碱性 |
碱性减弱、酸性增强 |
酸性减弱,碱性增强 |
|
|
气态氢化物的稳定性 |
渐增 |
渐减 |
|
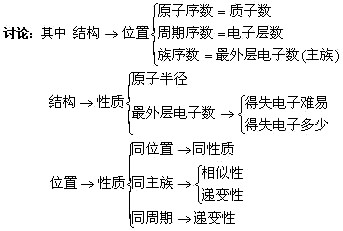
推导:原子结构、元素在周期表中的位置、元素性质之间的关系。
板书:三、位、构、性的关系
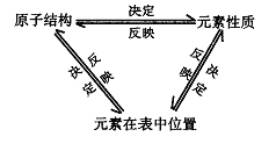
小结:
作业:收集有关元素周期表的小资料,各式各样的周期表以及周期表和周期律的意义。
板书设计:
第三节 元素周期表
一、元素周期表的结构
1.横:“三短、三长、一不全 ,镧系、锕系列下边”
2.纵: “七主七副八与零,镧系锕系挤当中”
二、同周期、同主族元素性质的递变规律
三、位、构、性的关系
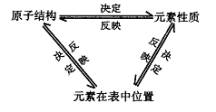
课题:第一节 元素周期表
第二课时
教学目标:
知识目标:
1.使学生了解原子结构、元素性质及该元素在周期表中的位置三者之间的关系,初步学会运用周期表。
2. 使学生对核素和同位素有常识性的认识。
能力目标:
通过对元素原子结构,位置间的关系的推导,增强学生的分析和推理能力。
情感目标:
1.加深学生对物质世界对立统一规律的认识。
2.辩证唯物主义量变质变的观点,在本节内容中有具体的体现。
3.对学生进行爱国主义教育。
教学过程:
练习:利用位、构、性的关系解题。
下表是元素周期表的一部分,回答下列有关问题:
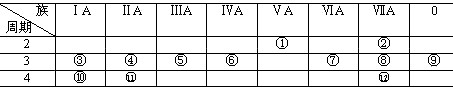
(1)写出下列元素符号:① ,⑥ ,⑦ , 11 。
(2)在这些元素中,最活泼的金属元素是 ,最活泼的非金属元素是 ,最不活泼的元素是 。
(3)在这些元素的最高价氧化物对应水化物中,酸性最强的是 ,碱性最强的是 ,呈两性的氢氧化物是 ,写出三者之间相互反应的化学方程式。
(4)在这些元素中,原子半径最小的是 ,原子半径最大的是 。
(5)在③与④中,化学性质较活泼的是 ,怎样用化学实验证明?答: 。在⑧与 12 中,化学性质较活泼的是 ,怎样用化学实验证明?答: 。
解析:解答本题关键要掌握:①1~20号元素的名称及符号;②元素周期表的结构;③能根据元素周期表中元素性质递变规律进行分析、判断。
参考答案:
(1)N;Si;S;Ca (2)K;F;Ar
(3) ![]() ;
; ![]() ,
,
![]() ,
, ![]()
(4)K;F
(5)Na;可以用它们跟水反应的实验证明:钠跟水剧烈反应,放出氢气,并生成强碱;Mg跟沸水才反应,放出氢气,并生成中强碱
![]() ;
; ![]() ;可用氯气通入溴化钠溶液的实验证明:溶液呈棕红色,发生的反应为
;可用氯气通入溴化钠溶液的实验证明:溶液呈棕红色,发生的反应为 ![]() 。
。
教师讲解此题:
学生讨论交流:元素周期表的意义,展示各式各样的周期表
此处教师可以演示元素周期表的ppt文件。还可以简要介绍元素名称的由来(此处可以参考相关的扩展资料)。
板书:四、元素周期表和元素周期表的意义。
讲述:五、核素、同位素
回忆:元素的概念、原子结构的知识。引出核素的概念。
板书:1. 核素:
讲述:同种元素的原子,质子数相同,但是中子数不一定相同,引出同位素的概念。
板书:2. 同位素:
说明:(1)绝大多数的元素有同位素,只较少数的没有,如Na、Al、F等。可知现发现有112种元素,但却有千多种原子。
(2)某元素的同位素均具有相同的原子结构,所以各种某元素的同位素具有基本相同的化学性质,但由于质量数不同。可使其有某些物理性质,如密度等的区别。在放射性上则某些同位素的性质差异显著。
介绍:氢的三种同位素。
简述:同位素的应用。(此处可以参考相关的扩展资料)
讲述:(3)某元素的天然同位素,各同位素所占的原子百分数(即摩尔百分数)又叫丰度,是定值。不论在其单质或化合物中同位素的丰度是不变的。
(4)同位素的质量数取整数,同位素的相对原子质量指精确值,是该同位素一个原子的质量与 ![]() 原子质量的1/12的比值,具有小数。
原子质量的1/12的比值,具有小数。
(5)某元素的相对原子质量,其精确值为该元素天然稳定同位素的相对原子质量与它们丰度的平均值。即:
相对原子质量= ![]() (天然同位素相对原子质量×丰度%)
(天然同位素相对原子质量×丰度%)
某元素的近似相对原子质量,可视为其同位素的质量数与它们丰度的平均值。即:
近似相对原子质量= ![]() (天然同位素的质量数×丰度%)
(天然同位素的质量数×丰度%)
以上是计算相对原子质量、同位素相对原子质量或质量数和同位素丰度的关系式。实际上精确测定元素的相对原子质量必须应用实验手段,而不能只凭上面的计算式。
介绍:我国著名化学家张青莲为元素相对原子质量的测定做出的卓越贡献。激发学生的爱国情怀。
比较:同位素与元素的区别。同位素指一种原子,而元素是指一类原子。元素包含同位素。
作业:
板书设计:
四、元素周期表和元素周期表的意义。
五、核素、同位素
1. 核素:
2. 同位素:
说明:(1)-(5)
3. 同位素与元素的区别。同位素指一种原子,而元素是指一类原子。元素包含同位素。