 设为首页
设为首页
 加入收藏
加入收藏
扩展资料
物质结构
二三百年前,人们发现物质由分子及原子组成。到19世纪末,在科学实验基础上,科学家认识到原子由原子核和核外电子构成。原子很小,直径约亿分之一厘米。原子核大约是原子的10万分之一,电子则更小,大约是原子的亿分之一。再进一步,人们发现原子核又是由质子和中子组成的。到此,曾有人以为找到了构成物质的最小“砖块”。然而,不久人们就发现了这种认识的局限性。通过对宇宙射线的观察分析和高能加速器的实验,又发现了比上述微粒更小、更基本的大批新粒子,如介子、中微子、反粒子以及组成质子、中子的夸克等,达到几百种之多。其中,大部分在自然界中并不存在,而是在高能束流的轰击下才产生出来的。
微观粒子之间存在不同的相互作用。根据这些相互作用力的特点,可把几百种粒子分为强子、轻子和传播子三类。强子是指参与强相互作用的那些粒子,包括质子。中子、π介子等。强子有其内部结构,由夸克组成。轻子与强作用无关,只参与弱力、电磁力和引力相互作用,如电子、中微子、μ子、τ子等。
人们会问:这样无限分下去有什么意义呢?一是哲学上的意义,证明世界的物质性和人类认识永无止境;二是科学理论上的意义,丰富了人们关于物质世界的基本知识;三是实践上的意义。当年对原子核内部结构的探索,导致了核能的广泛利用和开发。反物质有可能成为未来人类更强大的能源。除这些以外;研究超微观世界,需要庞大的高能实验设备,如对撞机、加速器等,这些设备的研制是高技术发展极强的推动力量,如我国自行设计、研制的北京正负电子对撞机,不仅取得了“精确测量τ轻子质量”这一高水平理论研究成果,而且,在对撞机的研制过程中,还带动了一大批高技术的发展。
大家知道物质是由分子组成的,分子又是由原子组成的,而原子又是由原子核和电子组成,原子核由质子等粒子组成。按照物理学中的等效真空理论,宇宙中的每一种粒子都应该有一与之对应的反粒子,它带有数值相等而符号相反的电荷,宇宙中有多少由质子,中子和电子结成的物质,就必定有同样多的反质子、反中子和正电子结成的反物质,宇宙中的正反物质
应该是严格对称的。
目前虽然发现和制造的反物质粒子并不多,但反物质的一种形式--正电子已经有了许多实际用途。例如正电子发射X射线层析照相术(PET),医生利用PET扫描不仅能得出病人软组织的详细图像,而且能够观察他们体内的化学过程,其中包括在进行认识活动时大脑各部分消耗"燃料"的速度。
反物质的一个潜在的且十分诱人的用途是利用来制造星际航行火箭的超级燃料。将氢和反氢混合湮灭来获得能量,那么这种燃料的1%克所产生的推力就相当于120吨由液态氢和液态氧组成的传统燃料。物质和反物质这一物理体系给物理学家、化学家、天体物理学家带来一系列新的课题,同时也给人类带来新的憧憬。
人类认识世界的脚步从来没有停止过,微观领域的研究更是如此,科学指引着哪些积极探索的人们不断向前。
扩展资料
发现电子
电子是在研究阴极射线的本质过程中得到的,阴极射线究竟是什么?物理学家汤姆逊设计了一个巧妙的实验装置,证实了阴极射线是由带负电荷的粒子组成的,并推算出其质量和电荷比值。得出来源于各种不同物质的阴极射线粒子都是一样的 ,而且是比原子小得多的粒子,其质量只是氢离子的千分之一。汤姆逊认定这种粒子必定是“建造一切化学元素的物质”,也就是一切化学原子所共有的组成部分。
,而且是比原子小得多的粒子,其质量只是氢离子的千分之一。汤姆逊认定这种粒子必定是“建造一切化学元素的物质”,也就是一切化学原子所共有的组成部分。
期间,物理学家佩兰利用当时刚问世的借助于散射光,分辨率比普通显微镜高20倍的超显微镜开展了一系列检验布朗运动理论的实验,于1909年发表了《布朗运动和分子实在性》的论文,引起强烈的反响,佩兰1926年获物理奖。至此,各国科学家一致认为,分子和原子的实在性已没有怀疑的余地了。正如爱因斯坦所说的那样“分子和原子是否存在的问题是他在大学时代关心和讨论的一个重大问题,而今天再也没有物理学家为这个问题而操心了”。
扩展资料
核外电子的排布规律
一、最低能量原理
所谓最低能量原理是,原子核外的电子,总是尽先占有能量最低的原子轨道,只有当能量较低的原子轨道被占满后,电子才依次进入 能量较高的轨道,以使原子处于能量最低的稳定状态。
原子轨道能量的高低为:
1.当n相同,l不同时,轨道的能量次序不s<p<d<f。例如,E3S<E3P<E3d。
2.当n不同,l相同时,n愈大,各相应的轨道能量愈高。例如,E2S<E3S<E4S。
3.当n和l都不相同时,轨道能量有交错现象。即(n-1)d轨道能量大于ns轨道的能量,(n-1)f轨道的能量大于np轨道的能量。在同一周期中,各元素随着原子序数递增核外电子的填充次序为ns,(n-2)f,(n-1)d,np。
核外电子填充次序如图1所示。
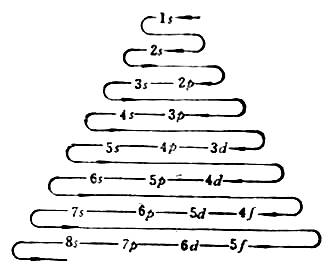
图1 电子填充的次序
二、鲍利(Pauli)不相容原理
鲍利不相容原理的内容 是:在同一原子中没有四个量子数完全相同的电子,或者说在同一原子中没有运动状态完全相同的电子。例如,氦原子的1s轨道中有两个电子,描述其中一个原子中没有运动状态的一组量子数(n,l,m,ms)为1,0,0,+1/2,另一个电子的一组量子数必然是1,0,0,-1/2,即两个电子的其他状态相同但自旋方向相反。根据鲍利不相容原理可以得出这样的结论,在每一个原子轨道中,最多只能容纳自旋方 向相反的两个电子。于是,不难推算出各电子层最多容纳的电子数为2n2个。例如,n=2时,电子可以处于四个量子数不同组合的8种状态,即n=2时,最多可容纳8个电子 ,见下表。
| N |
2 |
2 |
2 |
2 |
2 |
2 |
2 |
2 |
| L |
0 |
0 |
1 |
1 |
1 |
1 |
1 |
1 |
| M |
0 |
0 |
0 |
0 |
+1 |
+1 |
-1 |
-1 |
| ms |
+1/2 |
-1/2 |
+1/2 |
-1/2 |
+1/2 |
-1/2 |
+1/2 |
-1/2 |
在等价轨道中,电子尽可能分占不同的轨道,且自旋方向相同,这就叫洪特规则。
洪特规则实际上是最低能量原理的补充。因为两个电子同占一个轨道时,电子间的排斥作用会使体系能量升高,只有分占等价轨道,才有利于降低体系的能量。例如,碳原子核外有6个电子,除了有2个电子分布在1s轨道,2个电子分布在2s轨道外,另外2个电子不是占1个2p轨道,而是以自旋相同的方向分占能量相同,但伸展方向不同的两 个2p轨道。碳原子核外6个电子的排布情况如下:
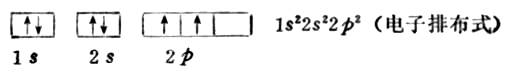
作为洪特规则的特例,等价轨道全充满,半充满或全空的状态是比较稳定的。全充满、半充满和全空的结构分别表示如下:
全充满: ![]() ;半充满:
;半充满: ![]() ;全空:
;全空: ![]() 。
。
用洪特规则可以解释为什么Cr原子的外层电子排布为3d54s1而不是3d44s2,Cu原子的外层电子排布为3d104s1而不是3d94s2。
应该指出,核外电子排布的原理是从大量事实中概括出来的一般规律,绝大多数原子核外电子的实际排布与这些原理是一致的。但是随着原子序数的增大,核外电子排布变得复杂,用核外电子排布的原理不能满意地解释某些实验的事实。在学习中,我们首先应该尊重事实,不要拿原理去适应事实。也不能因为原理不完善而全盘否定原理。科学的任务是承认矛盾,不断地发展这些原理,使之更加趋于完善。
扩展资料
核外电子的运动状态
电子在原子中的运动状态,可以用n,l,m,ms四个量子数来描述。
一、主量子数n
主量子数n是用来描述原子中电子出现几率最大区域离核 的远近,或者说它是决定电子层数的。主量子数的n的取值为1,2,3…等正整数。例如,n=1代表电子离核的平均距离最近的一层,即第一电子层;n=2代表电子离核的平均距离比第一层稍远的一层,即第二电子层。余此类推。可见n愈大电子离核 的平均距离愈远。
在光谱学上常用大写拉丁字母K,L,M,N,O,P,Q代表电子层数。
| 主量子数(n) |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
| 电子层符号 |
K |
L |
M |
N |
O |
P |
Q |
主量子数n是决定电子能量高低的主要因素。对单电子原子来说,n值愈大,电子的能量愈高。但是对多电子原子来说,核外电子的能量除了同主量子数n有关以外还同原子轨道(或电子云)的形状有关。因此,n值愈大,电子的能量愈高这名话,只有在原子轨道(或电子云)的形状相同的条件下,才是正确的。
二、副量子数l
副量子数又称角量子数。当n给定时,l可取值为0,1,2,3…(n-1)。在每一个主量子数n中,有n个副量子数,其最大值为n-1。例如n=1时,只有一个副量子数,l=0,n=2时,有两个副量子数,l=0,l=1。余此类推。按光 谱学上的习惯l还可以用s,p,d,f等符号表示。
| l |
0 |
1 |
2 |
3 |
| 光谱符号 |
s |
p |
d |
F |
副量子数l的一个重要物理意义是表示原子轨道(或电子云)的形状。L=0时(称s轨道),其原子轨道(或电子云)呈球形分布;l=1时(称p轨道),其原子轨道(或电子云)呈哑铃形分布如图所示;…
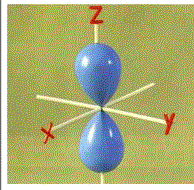
图 为 p电子云
副量子数l的另一个物理意义是表示同一电子层中具有不同状态的亚层。例如,n=3时,l可取值为0,1,2。即在第三层电子层上有三个亚层,分别为 s,p,d亚层。为了区别不同电子层上的亚层,在亚层符号前面冠以电子层数。例如,2s是第二电子层上的亚层,3p是第三电子层上的p亚层。表4-1列出了主量子数n,副量子数l及相应电子层、亚层之间的关系。
表中为主量子数n,副量子数l及其相应电子层亚层之间的关系
| n |
电子层 |
l |
亚层 |
| 1 |
1 |
0 |
1s |
|
2 |
2 |
0 |
2s |
| 1 |
2p |
||
|
3 |
3 |
0 |
3s |
| 1 |
3p |
||
| 2 |
3d |
||
|
4 |
4 |
0 |
4s |
| 1 |
4p |
||
| 2 |
4d |
||
| 3 |
4f |
前已述及,对于单电子体系的氢原子来说,各种状态的电子能量只与n有关。但是对于多电子原子来说,由于原子中各电子之间的相互作用,因而当n相同,l不同时,各种状态的电子能量也不同,l愈大,能量愈高。即同一电子层上的不同亚层其能量不同,这些亚层又称为能级。因此副量子数l的第三个物理意义是:它同多电子原子中电子的能量有关,是决定多电子原子中电子能量的次要因素。
三、磁量子数m
磁量子数m决定原子轨道(或电子云)在空间的伸展方向。当l给定时,m的取值为从- l到+l之间的一切整数(包括0在内),即0,±1,±2,±3,…±l,共有2l+1个取值。即原子轨道(或电子云)在空间有2l+1个伸展方向。原子轨道(或电子云)在空间的每一个伸展方向称做一个轨道。例如,l=0时,s电子云呈球形对称分布,没有方向性。m只能有一个值,即m=0,说明s亚层只有一个轨道为s轨道。当l=1时,m可有-1,0,+1三个取值,说明p电子云在空间有三种取向,即p亚层中有三个以x,y,z轴为对称轴的px,py,pz轨道。当 l=2时,m可有五个取值,即d电子云在空间有五种取向,d亚层中有五个不同伸展方向的d轨道。 n,l相同,m 不同的各轨道具有相同的能量,把能量相同的轨道称为等价轨道。
四、自旋量子数ms
原子中的电子除绕核作高速运动外,还绕自己的轴作自旋运动。电子的自旋运动用自旋量子数ms表示。ms 的取值有两个,+1/2和-1/2。说明电子的自旋只有两个方向,即顺时针方向和逆时针方向。通常用“↑”和“↓”表示 。
综上所述,原子中每个电子的运动状态可以用n,l,m,ms四个量子数来描述。主量子数n决定电子出现几率最大的区域离核的远近(或电子层),并且是决定电子能量的主要因素;副量子数 l决定原子轨道(或电子云)的形状,同时也影响电子的能量;磁量子数m决定原子轨道(或电子云)在空间的伸展方向;自旋量子数ms决定电子自旋的方向。因此四个量子数确定之后,电子在核外空间的运动状态也就确定了。
扩展资料
核外电子运动的特征
我们知道,地球沿着固定轨道围绕太阳运动,地球的卫星(月球或人造卫星)也以固定的轨道绕地球运转。这些宏观物体运动的共同规律是有固定的轨道,人们可以在任何时间内同时准确地测出它们的运动速度和所在位置。电子是一种极微小的粒子,质量为9.1×10-31kg,在核外的运动速度快(接近光速)。因此电子的运动和宏观物体的运动不同。和光一样,电子的运动具有微粒性和波动性的双重性质。对于质量为m,运动速度为v的电子,其动量为:P=mv,其相应的波长为:λ=h/P=h/mv式中,左边是电子的波长λ,它表明电子波动性的特征,右边是电子的动量P(或mv),它表明电子的微粒性特征,两者通过普朗克常数h联系起来。
实验证明,对于具有波动性的微粒来说,不能同时准确地确定它在空间的位置和动量(运动速度)。也就是说电子的位置测得愈准时,它的动量(运动速度)就愈测不准,反之亦然。但是用统计的方法,可以知道电子在原子中某一区域内出现的几率。
电子在原子核外空间各区域出现的几率是不同的。在一定时间内,在某些地方电子出现的几率较大。而在另一些地方出现的几率较小。对于氢原子来说,核外只有一个电子。为了在一瞬间找到电子在氢原子核外的确切位置,假定我们用高速照相机给某个氢原子拍几万张照片,叠加这些照片进行分析,发现原子核外的一个电子在核外空间各处都有出现的可能,但在各处出现的几率不同。如果用小黑点的疏密来表示电子在核外各处的几率密度(单位体积中出现的几率)大小,黑点密的地方,是电子出现几率密度大的地方;疏的地方,是电子出现几率密度小的地方。像这样用小黑点的疏密形象地描述电子在原子核外空间的几率密度分布图象叫做电子云。所以电子云是电子在核外运动具有统计性的一种形象表示法。
氢原子的电子云是球形的,离核越近的地方其电子云密度越大。但是由于离原子核越近,球壳的总体积越小,因此在这一区域内黑点的总数并不多。而是在半径为53pm
附近的球壳中电子出现的几率最大,这是氢原子最稳定状态。为了方便,通常用电子云的界面表示原子中电子云的分布情况。所谓界面,是指电子在这个界面内出现的几率很大(95%以上),而在界面外出现的几率很小(5%以下)。