 设为首页
设为首页
 加入收藏
加入收藏
教学设计方案(一)
课题:第一节 原子结构
第一课时
教学目标:
知识目标:
掌握原子构成的初步知识;构成原子的粒子间的关系。
能力目标:
对概念的理解能力和分析能力。
情感目标:
1.培养学生的唯物观,世界是物质的。
2.物质的运动是有规律的。
3.培养学生用普遍联系的观点分析问题。
教学重点:构成原子的粒子间的关系
教学过程:
引入:前面我们学习了典型金属元素碱金属和典型非金属元素卤素的知识,性质的形似与递变和结构有密切的联系,从今天开始我们将学习有关物质结构的知识。
提问:初中化学学习了哪些有关原子结构的知识?
小结并板书:

核电荷数=核内质子数=核外电子数
指导学生阅读:教材中有关原子及其组成粒子的质量的内容
让学生辨析:绝对质量和相对质量,首先,讨论绝对质量(真实质量),质子的绝对质量为1.6726×10-27kg,电子的质量大约是质子质量的
![]() ,然后引导学生得出结论:既然是相对质量,就得有一个质量标准,提问学生:这个质量标准是什么?
,然后引导学生得出结论:既然是相对质量,就得有一个质量标准,提问学生:这个质量标准是什么?
学生计算:质子的相对质量为1.007,中子的相对质量为1.008,并且引导学生回忆相对原子质量的概念。
讲述:忽略电子的质量,将原子核内所有的质子和中子的相对质量取近似整数值加起来所得的数值,叫做质量数,符号A。
板书:质量数(A)=质子数(Z)+中子数(N)
思考:某原子的质量数能否为小数?以质子数为11,中子数为12的钠原子为例。
学生讨论:
教师评价:质量数是整数值
思考:质量数表示原子的质量关系,质子数、中子数是数量关系,为何二者能画等号?
学生讨论:
教师评价:质量数=质子相对质量+中子相对质量=1个质子相对质量×质子数+1个中子相对质量×中子数,由于二者的相对质量均近似为1,所以才有:质量数(A)=质子数(Z)+中子数(N),从而把质量关系和数量关系联系了起来。
小结:

讲述: ![]() 的含义。
的含义。
观看视频:原子的结构
练习巩固:
1.
已知 ![]() 五种简单离子的核外电子数相等,与它们对应的原子的核电荷数由大到小的顺序是
。
五种简单离子的核外电子数相等,与它们对应的原子的核电荷数由大到小的顺序是
。
参考答案:E、D、C、B、A
2.现有 ![]() 和
和 ![]() 两种离子,它们的电子层结构相同,则
两种离子,它们的电子层结构相同,则 ![]() 与下列式子有相等关系的是( )
与下列式子有相等关系的是( )
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
参考答案:B
3.某元素的阳离子
![]() ,核外共用x个电子,原子的质量数为A,则该元素原子里的中子数为(
)
,核外共用x个电子,原子的质量数为A,则该元素原子里的中子数为(
)
A.![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
参考答案:A
4.(94上海)某微粒用 ![]() 表示,下列关于该微粒的叙述正确的是( )
表示,下列关于该微粒的叙述正确的是( )
A.所含质子数=A-n B.所含中子数=A-Z
C.所含电子数=Z+n D.质量数=Z+A
参考答案:B
5.(95全国)据报导,1994年12月科学家发现了一种新元素,它的原子核内有161个中子,质量数272。该元素的原子序数为( )
A.111 B.161 C.272 D.433
参考答案:A
板书设计:
第一节 原子结构
一、原子核
1.

教学设计方案(二)
课题:第一节 原子结构
第二课时
教学目标:
知识目标:
1.原子核外电子运动的特征。
2.了解核外电子的分层排布规律,能画出1~18号元素的原子结构示意图
能力目标:
1.空间的想象能力和抽象思维能力。
2.分析推理能力。
情感目标:
1.培养学生的唯物观,世界是物质的。
2.物质的运动是有规律的。
3.培养学生用普遍联系的观点分析问题。
教学重点:原子核外电子的排布规律
教学难点:原子核外电子运动的特征,电子云,原子核外电子的排布规律。
教学过程:
引入:普通物体的运动有固定的轨迹,可以测定或根据一定的数据计算出来在某一时刻的位置,并且能描绘出其运动轨迹。而原子核外电子的运动没有固定的轨迹,不能测定或计算出电子在某一时刻的位置,也无法描绘出其运动轨迹。但是电子的运动并不是毫无规律可循的。今天我们将学习有关核外电子运动的知识。
板书:二、核外电子运动特征
1. 核外电子运动的特殊性:质量小带负电荷,运动范围小,速度快,与宏观物体不同。
讲述:我们在描述核外电子的运动时,只能指出它在原子核外空间某处出现机会的多少。电子在原子核外空间一定范围内出现,可以想象为一团带负电荷的云雾笼罩在原子核周围,所以,人们形象地把它叫做“电子云”
板书:2. 电子云
投影演示:采用给氢原子照相的比喻来讲解电子云概念,将事先绘制的投影片逐张重叠放映出来,使学生对电子在原子核外的运动情形有生动鲜明的印象,从而形成电子云的概念。
阅读:教材中氢原子核外电子运动的相关内容
学生讨论:氢原子电子云示意图呈什么形状?小黑点的分布有什么规律?电子在核外单位体积空间中出现机会的多少与离核远近有什么关系?
师生共同小结:(1)呈球形对称。(2)在离核近处密度大,离核远处密度小。(3)在离核近处单位体积的空间电子出现的机会多,在离核远处单位体积的空间电子出现的机会少。
教师举例:蜜蜂采蜜,其行踪没有规则,但是哪里花多,它在哪里出现的几率就越多。
过渡:氢原子只有一个电子,因此其运动情况比较简单。钠原子核外有11个电子,这11个电子的运动情况同样可以用电子云来描述,但是这11个电子各有其运动区域。让学生画出钠原子的结构示意图。
讲述:我们把核外电子运动的不同区域看成不同的电子层,并用n=1、2、3、4、5、6、7表示从内到外的电子层,这七个电子层又可分别称为K、L、M、N、O、P、Q层。
板书:三、原子核外电子的排布规律
1. 核外电子是分层排布的
2. 不同电子层上的电子能量不同,离核越近,能量越低。
提问:氯原子有几个电子层,每层有几个电子,能量最高的电子在哪一层?
3. 电子优先排布在能量最低的电子层里。
提出:每个电子层最多可以排布多少个电子呢?请同学们研究一下稀有气体元素原子电子层排布的情况,自己得出结论。
学生讨论:
小结:4. 每个电子层所能容纳的电子数为2n2(n为电子层数)。
提问:第N层最多能容纳多少电子?那么教材中氙原子核外电子排布为2、8、18、18、8。N层只有18个电子,为什么?
指导学生填表:1~20元素原子的核外电子排布,找出规律。
小结:5. 最外层电子数不超过8个(K为最外层时不超过2个),次外层不超过18个,倒数第三层不超过32个。
提问: 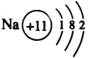 原子结构示意图错在哪里?
原子结构示意图错在哪里?
练习巩固:
1. 某元素原子的最外层电子数为次外层电子数的3倍,则该元素原子核内质子数为( )
A.3 B.7 C.8 D.10
答案:C
2. (97年高考题)下列各组微粒中,核外电子总数相等的是( )
(A) ![]() (B)
(B) ![]()
(C)![]() (D)
(D) ![]()
答案:D
作业:本节书后练习
板书设计:
二、核外电子运动特征
1. 核外电子运动的特殊性:质量小带负电荷,运动范围小,速度快,与宏观物体不同。
2. 电子云
三、原子核外电子的排布规律
1. 核外电子是分层排布的
2. 不同电子层上的电子能量不同,离核越近,能量越低。
提问:氯原子有几个电子层,每层有几个电子,能量最高的电子在哪一层?
3. 电子优先排布在能量最低的电子层里。
4. 每个电子层所能容纳的电子数为2n2(n为电子层数)。
5. 最外层电子数不超过8个(K为最外层时不超过2个),次外层不超过18个,倒数第三层不超过32个。