 设为首页
设为首页
 加入收藏
加入收藏
教学设计示例一
第二节 气体摩尔体积
第一课时
知识目标
使学生在了解气体的体积与温度和压强有密切关系的基础上,理解气体摩尔体积的概念。
能力目标
通过气体摩尔体积的概念和有关计算的教学,培养学生分析、推理、归纳、总结的能力。
情感目标
通过本节的教学,激发学生的学习兴趣,培养学生的主动参与意识。
通过教学过程中的设问,引导学生科学的思维方法。
教学重点:气体摩尔体积的概念
教学难点:相同温度和压强下,相同物质的量的任何气体所占的体积大约相同的原因。
教学方法:设疑、导思、归纳、应用
教学手段:多媒体辅助
教学过程:
[复习提问] 1.1mol物质含有的粒子数约是多少?
2.什么叫摩尔质量?
[引入新课] 前面我们学习的物质的量,它把宏观上可称量的物质与微观粒子联系起来,宏观上可感知的除了物质的质量,还有物质所占的体积上节课我们研究了1mol物质所具有的质量,这节课我们来讨论1mol物质所占的体积。
[板书] 一、气体摩尔体积
1.1mol固、液态物质的体积
[提问] 已知物质的质量和密度,怎样求体积?
学生回答:V= ![]()
[投影] 计算1mol几种固、液态物质的体积,填表;
|
物质 |
粒子数 |
1mol 物质质量(g) |
20℃密度(g/cm3) |
体积(cm3) |
|
Fe |
6.02×1023 |
56 |
7.8 |
|
|
Al |
6.02×1023 |
27 |
2.7 |
|
|
Pb |
6.02×1023 |
207 |
11.3 |
|
|
H2O |
6.02×1023 |
18 |
1(4℃) |
|
|
H2SO4 |
6.02×1023 |
98 |
1.83 |
学生分组计算出1molFe、Al、Pb、H2O、H2SO4的体积分别为:7.2、10、18.3、18、53.6cm3
[微机显示] 1mol物质的体积
[板书] 1mol固、液态物质的体积不相同。
2.1mol气态物质的体积
[微机显示] 影响气体体积的因素
指导学生注意观察分子间平均距离的变化。
[说明] 比较一定质量气体的体积,必须在相同温度和压强条件下。
[板书] 标准状况:0℃,101kPa
[投影] 计算标准状况下,1mol H2、O2、CO2气体的体积,并填表:
|
气体 |
粒子数 |
1mol物质质量(g) |
密度(g/L) |
体积(L) |
|
H2 |
6.02×1023 |
2.016 |
0.0899 |
|
|
O2 |
6.02×1023 |
32.00 |
1.429 |
|
|
CO2 |
6.02×1023 |
44.01 |
1.977 |
学生分组计算出标准状况下,1mol H2、O2、CO2的体积分别为:22.4L、22.4L、22.3L
[板书] 在标准状况下,1mol任何气体所占的体积都约是22.4L。
[强调] ①标准状况(0℃,101Kpa)②物质的量为1mol ③任何气体物质 ④约为22.4L
[展示] 22.4L体积的实物模型
[设疑] 在其它的温度和压强下,1mol气体是否占有大约相同的体积呢?
[板书] 单位物质的量气体所占的体积叫做气体摩尔体积。
Vm = ![]() 单位:L/mol
单位:L/mol
[提问] 气体摩尔体积与标准状况下气体摩尔体积22.4L/mol是什么关系?
[强调] 22.4L/mol只是在特定条件下的气体摩尔体积。气体摩尔体积是在任意温度、压强下,气体体积与气体物质的量之比。
[设问] 为什么在一定温度、压强下,1mol固、液态物质体积不同,而1mol气体体积都大致相同呢?让我们从物质的组成和结构上找找原因。
[讨论] 决定物质体积的主要因素
[微机显示] 影响物质体积的因素
[提问] 1.1mol液态水变为1mol水蒸气分子数是否变化?
2.为什么体积由18mL变为3.06×104mL,体积扩大了1700倍。
[指出] 在粒子数相同的条件下,固、液态物质的体积主要决定于构成物质的粒子的大小,由于构成不同物质的粒子的大小不同,所以1mol固、液态物质的体积不相同;气体的体积主要决定于粒子间的距离,不同气体分子间的平均距离大约相等,所以1mol气体的体积大致相同。
[结论] 在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子。即阿伏加德罗定律。应用:同温同压: ![]() ,还可推导出
,还可推导出 ![]()
[练习] (投影)下列说法是否正确?如不正确,指出错误的原因。
1. 1mol任何气体的体积都是22.4L。
2. 1molH2的质量是1g,它所占的体积是22.4L/mol。
3. 1mol任何物质在标准状况时所占的体积都约为22.4L。
4.22.4LO2一定含有6.02×1023个O2。
5.在同温同压下,32gO2与2gH2所占的体积相同。
6. 在同温同压下,20mLNH3与60mLO2所含的分子个数比为1:3。
(答案:正确的是5.6.)
板书设计:
第二节 气体摩尔体积
一、气体摩尔体积
1.1mol固、液态物质的体积
1mol固、液态物质的体积不相同。
2.1mol气态物质的体积
标准状况:0℃,101Kpa
在标准状况下,1mol任何气体所占的体积都约是22.4L。
单位物质的量气体所占的体积叫做气体摩尔体积。
Vm = ![]() 单位:L/mol
单位:L/mol
在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子。即阿伏加德罗定律。应用:同温同压: ![]() ,还可推导出
,还可推导出 ![]()
教学设计示例二
第二节 气体摩尔体积
第二课时
知识目标:
使学生在理解气体摩尔体积,特别是标准状况下,气体摩尔体积的基础上,掌握有关气体摩尔体积的计算。
能力目标
通过气体摩尔体积的概念和有关计算的教学,培养学生分析、推理、归纳、总结的能力。
通过有关气体摩尔体积计算的教学,培养学生的计算能力,并了解学科间相关知识的联系。
情感目标
通过本节的教学,激发学生的学习兴趣,培养学生的主动参与意识。
通过教学过程中的设问,引导学生科学的思维方法。
[板书] 二、有关气体摩尔体积的计算
[讨论] 气体的体积与气体的物质的量、气体的质量和气体中的粒子数目之间的关系:(由学生回答)
[板书]
1.
依据: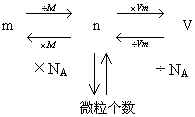 和阿伏加德罗定律及其推论
和阿伏加德罗定律及其推论
2.类型
(1)标准状况下气体的体积与气体的物质的量、气体的质量和气体中的粒子数目之间的关系
[投影] 例题1:在标准状况下,2.2gCO2的体积是多少?
[讨论] 1.由学生分析已知条件,确定解题思路。
2.学生在黑板上或练习本上演算。
[强调] 1.解题格式要求规范化。
2.计算过程要求带单位。
[板书](2)气体相对分子质量的计算
[投影] 例题2:在标准状况下,测得1.92g某气体的体积为672mL。计算此气体的相对分子质量。
[讨论] 分析已知条件首先计算气体的密度: ![]() =
= ![]()
然后求出标准状况下22.4L气体的质量,即1mol 气体的质量:M= ![]() Vm
Vm
[学生解题] 分析讨论不同的解法。
[投影] 例题3:填表
|
物质 |
物质的量 |
体积(标准状况) |
分子数 |
质量 |
密度 |
|
H2 |
0.5mol |
||||
|
O2 |
44.8L |
||||
|
CO2 |
44/22.4g.L-1 |
||||
|
N2 |
28g |
||||
|
Cl2.HCl混合气 |
3.01×1023 |
[练习]若不是标准状况下,可以利用阿伏加德罗定律及其推论解题。
某气体对氢气的相对密度为14,求该气体的相对分子质量。
[分析]由于是同温同压,所以式量的比等于密度比。
[板书](3)混合气体
[投影] 例题3:已知空气中氮气和氧气的体积比为4 :1,求空气的平均相对分子质量。
[分析] 已知混合气体的组成,求其相对分子质量,应先求出混合气体的平均摩尔质量。如用n1、n2……表示混合物中各组分的物质的量;M1、M2……表示混合物中各组分的摩尔质量;V1、V2……表示混合物中各组分的体积,则混合气体的平均摩尔质量可由下面的公式求得:
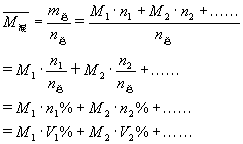
计算的结果是空气的平均相对分子质量为29。这一数值要求学生记住,这样在以后的学习中判断某气体的密度比空气的大还是小,直接把二者的相对分子质量进行比较即可。例如:二氧化碳的式量为44>29,密度比空气的大。氢气的式量2<29,密度比空气的小。CO的式量为28,密度与空气的接近。
[小结] 气体摩尔体积概念、公式、单位
标准状况下气体摩尔体积为22.4L/mol。
[课堂检测]
1.在相同的条件下,两种物质的量相同的气体必然( )
A.体积均为22.4L B.具有相同的体积
C.是双原子分子 D.具有相同的原子数目
2. 同温、同压下,H2和He两种气体单质的,如果质量相同,下列说法错误的是( )
A.体积比为2 :1 B.原子个数之比为2 :1
C.密度之比为1 :2 D.质子数之比为1 :1
参考答案:1. B 2. B、D
[作业] 质量监测有关习题
板书设计:
二、有关气体摩尔体积的计算
1.
依据: 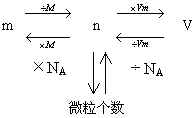 和阿伏加德罗定律及其推论
和阿伏加德罗定律及其推论
2.类型
(1)标准状况下气体的体积与气体的物质的量、气体的质量和气体中的粒子数目之间的关系
(2)气体相对分子质量的计算
(3)混合气体