 设为首页
设为首页
 加入收藏
加入收藏
常见碱、盐的溶解性
碱与盐或盐与盐发生复分解反应的条件有二:一是反应物都溶于水,二是生成物中至少有一种是沉淀物。可见要正确判断这两类复分解反应能否发生,必须掌握常见的碱、盐在水中溶解的情况。
根据碱在水中的溶解性不同,分为可溶性碱和不溶性碱。在常见的碱中,氢氧化钠 ![]() 、氢氧化钾
、氢氧化钾 ![]() 、氢氧化钡
、氢氧化钡 ![]() 、氨水(主要成分
、氨水(主要成分 ![]() )等属于可溶性碱;固体氢氧化钙
)等属于可溶性碱;固体氢氧化钙 ![]() 微溶于水,石灰水是氢氧化钙水溶液;其他属于不溶性碱,如氢氧化镁
微溶于水,石灰水是氢氧化钙水溶液;其他属于不溶性碱,如氢氧化镁 ![]() 、氢氧化铜
、氢氧化铜 ![]() 、氢氧化铁
、氢氧化铁 ![]() 等。
等。
常见的盐在水中溶解性的规律有:钾盐、钠盐、铵盐和硝酸盐都易溶于水;盐酸盐(氯化物)除氯化银外都溶于水;硫酸盐除硫酸铅、硫酸钡不溶于水,硫酸钙、硫酸汞和硫酸银微溶于水外,其他都溶于水;碳酸盐和磷酸盐的正盐中,除钾盐、钠盐、铵盐外,都不溶于水。
可溶性碱在水溶液中能明显地表现出氢氧根离子具有的性质—碱的通性,如使酸碱指示剂变色、能跟酸性氧化物反应生成盐和水、能跟酸反应生成盐和水等。不溶性碱在水中溶解度很小,使某些碱的通性表现不明显,如有的不能使酸碱指示剂变色、不能跟盐发生复分解反应等。除氨水外的可溶性碱在受热时不发生分解,而不溶性碱具有受热分解的性质,一般分解生成碱性氧化物和水。如 ![]()
![]()
![]() ,
,
![]()
![]()
![]() ,
, ![]()
![]()
![]() 等。以上可溶性碱与不溶性碱的某些性质上的差异,说明各种金属阳离子对氢氧根离子的影响不同。
等。以上可溶性碱与不溶性碱的某些性质上的差异,说明各种金属阳离子对氢氧根离子的影响不同。
复分解反应的条件、前提和规律
复分解反应是中学化学基础知识的重要内容,如孤立地去死记这些反应的化学方程式,常会感到复杂纷繁,更难于运用。故借此谈谈复分解反应的有关知识,供大家在教与学时参考。
一、准确领会定义和条件
从化学反应的形式来看,复分解反应就是由两种化合物相互交换成分而生成另外两种化合物的反应。可简单表示为:
AB+CD=AD+CB
实验证明,复分解反应常发生在两种碱、酸、盐及氧化物之间,两种化合物发生复分解反应的条件是:生成物中有沉淀析出,或有气体放出,或有水(难电离的物质)生成。若满足上述条件之一,复分解反应就可以发生,否则就不能发生。如:
BaCl2+NaSO4=BaSO4↓+2NaCl
有的同学只顾生成物中符合上述条件之一,就盲目确认某些反应为复分解反应。如:
3CO+Fe2O3=2Fe+3CO2
虽然此反应生成物中有气体放出,但对照定义,可知此反应不是复分解反应,因为CO与Fe2O3没有相互交换成分而生成另外两种化合物。判断时,必须把定义和条件结合起来考虑。有的同学片面认为复分解反应一定要在水溶液中进行。其实不然,某些复分解反应在干燥条件下便可发生。如:
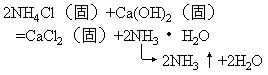
有的同学硬背定义和条件,认为硫酸和氯化钠溶液能发生下列反应:
H2SO4+2NaCl=Na2SO4+2HCl↑
分析知道,假设反应能发生,生成的氯化氢几乎全部溶于反应体系的水中,不能逸出,故此反应是不能进行到底的。
另外,不少同学常写出类似如下的方程式:
1.2FeCl3+3Mg(OH)2=2Fe(OH)3↓+3MgCl2
2.BaCO3+CaCl2=CaCO3↓+BaCl2
3.H2SiO3+Cu(OH)2=CuSiO3↓+2H2O
上述复分解反应均不能发生。为什么呢?
二、透彻理解实质和前提
复分解反应的实质是离子之间的反应。只有反应物先离解出一定数目的离子(在溶液中),然后交换结合成沉淀、气体和水(难电离的物质),使体系中离子的数量减少,才能发生复分解反应。而反应物能否离解出一定数量的离子,是发生复分解反应的前提,这又决定于反应物的性质和状态。上述1、2、3三个反应不能发生的关键就在于有的反应物很难在溶液中产生离子。虽然有的反应物产生大量离子,但不能相互结合而减少。氯化钾溶液与硝酸钠溶液不能反应的原因就是如此。
两种化合物能否发生复分解反应,除与外界条件有关外,更重要的是与反应物和生成物的稳定性、挥发性及在水中的溶解性有关。这是判断复分解反应能否发生和生成什么产物的依据。故大家只有熟记常用酸、碱、盐及氧化物的性质,才能掌握复分解反应发生的规律。
三、系统掌握类型和规律
酸、碱、盐、氧化物间的复分解反应的一般判断规律如何呢?现根据反应的条件和前提分类归纳如下:
1.碱+酸→盐+水
反应物均可溶或其一可溶,反应才能发生。
如:Fe(OH)3+3HCl=FeCl3+3H2O
2.碱+盐→新碱+新盐
反应物必须都可溶且生成物中至少有一种为沉淀或易分解放出气体,反应才能发生。
如:2KOH+CuCl2=Cu(OH)2↓+2KCl
3.酸+盐→新酸+新盐
(1)反应物都可溶,且生成物中有一种沉淀,反应才能发生。但稳定酸生成的盐与不稳定酸不能反应。
如:AgNO3+HCl=AgCl↓+HNO3
CaCl2+H2CO3不能反应
(2)若某反应物为不稳定酸生成的盐(或酸式盐),不论该盐是否可溶,都可与稳定酸反应,而且有气体生成。
如:
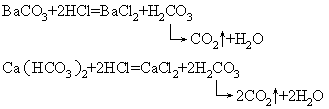
(3)浓高沸点酸与挥发性酸生成的盐也能反应。
如:H2SO4(浓)+NaCl(固) ![]() NaHSO4+HCl↑
NaHSO4+HCl↑
4.盐+盐→新盐+新盐
反应物必须均可溶,生成物中至少有一种是沉淀,反应才能发生。
如:CaCl2+Na2SO4=CaSO4↓+2NaCl
若反应物中有一种较难溶的盐,生成物中有一种更难溶的盐,则反应也能发生。
如:CaSO4+Na2CO3=CaCO3↓+Na2SO4
5.酸+碱性氧化物→盐+水
该类反应和某酸与此碱性氧化物对应的水化物反应的情形、结果相同。
如:CuO+2HCl=CuCl2+H2O
6.碱+酸性氧化物→盐+水
这类反应和某碱与该对应酸反应的情形、结果相同。
如:CO2+Ca(OH)2=CaCO3↓+H2O
可见,只有全面掌握了解复分解反应的条件、前提和规律,才能准确分析和解决一些实际问题。
关于结晶水合物
某些盐从溶液中析出晶体时,往往带有不同数目的结晶水。如从饱和硫酸铜溶液中析出的硫酸铜晶体为 ![]() (胆矾),从自然界某些盐湖中析出的碳酸钠晶体为
(胆矾),从自然界某些盐湖中析出的碳酸钠晶体为 ![]() 。常见的结晶水合物有:明矾
。常见的结晶水合物有:明矾 ![]() (十二水合硫酸铝钾)、绿矾
(十二水合硫酸铝钾)、绿矾 ![]() (七水合硫酸亚铁)、生石膏
(七水合硫酸亚铁)、生石膏 ![]() (二水合硫酸钙)、芒硝
(二水合硫酸钙)、芒硝 ![]() (十水合硫酸钠)、皓矾
(十水合硫酸钠)、皓矾 ![]() (七水合硫酸锌)等。
(七水合硫酸锌)等。
结晶水合物的结构较复杂,其内部不是分为无水化合物和水两个独立部分,它们已相互结合成统一整体,表现在结晶水合物是有固定组成的,因而结晶水合物属于纯净物,不属于混合物。上述几种结晶水合物都属于无机化合物中的盐类。
在一定条件下,结晶水合物可以失去部分或全部结晶水;无水化合物可以与一定量水化合成结晶水合物。例如:加热胆矾可以使其转化为无水硫酸铜,而无水硫酸铜遇水生成胆矾。胆矾为蓝色晶体,无水硫酸铜为白色粉末,二者的式量及性质不同,它们不是同一种物质,故上述的结晶水合物与相应无水物之间的转化属于化学变化,可以用化学方程式表示出:
![]()
![]()
![]() ,
, ![]()
![]()
![]() 。由于无水硫酸铜容易吸收空气中或通过它的气体中的水蒸气而生成胆矾,从白色粉末变为蓝色,所以无水硫酸铜常用作检验气体或液态物质(如酒精)中是否含有水分的试剂。碳酸钠晶体风化成无水碳酸钠,也属于化学变化:
。由于无水硫酸铜容易吸收空气中或通过它的气体中的水蒸气而生成胆矾,从白色粉末变为蓝色,所以无水硫酸铜常用作检验气体或液态物质(如酒精)中是否含有水分的试剂。碳酸钠晶体风化成无水碳酸钠,也属于化学变化:
![]()
![]()
![]()
实验室常用胆矾溶于水配制成硫酸铜溶液,在所得溶液中溶质为 ![]() ,而不是
,而不是 ![]() ,胆矾中的结晶水已并入溶剂水中,在计算时应注意这点。例如:将5克胆矾溶解于95克水中,所得硫酸铜溶液中溶质的质量分数不是5%,而应进行如下计算:
,胆矾中的结晶水已并入溶剂水中,在计算时应注意这点。例如:将5克胆矾溶解于95克水中,所得硫酸铜溶液中溶质的质量分数不是5%,而应进行如下计算:

硫酸铜与波尔多液
铜的化合物大多为蓝色和绿色。其中最为人们熟悉的是硫酸铜,它可以制成很规则的蓝色透明大晶体。在有人工合成的有机农药之前,硫酸铜曾经是广泛使用的杀菌剂,它的发明还流传着一个很有趣的故事。
在盛产葡萄酒的法国南部地中海沿岸,气候湿润,阳光充足,满山遍野都点缀着葡萄园。每当葡萄成熟的季节,一串串像珍珠和玛瑙的紫红色、翠绿色、玫瑰色的葡萄悬挂在葡萄架上。此时,葡萄园的主人们一面怀着丰收的喜悦,一面面还要时时刻刻提防着顽皮的少年儿童以及路边的游客。他们见了这些美丽和可口的葡萄,垂涎欲滴,往往不告诉葡萄园的主人,一个个自己动手采摘,饱食一顿。
为了防止这种意外的损失,葡萄园的主人们不得已而想出了一种防小偷的办法,他们把一种由硫酸铜和生石灰配制而成的溶液喷洒在葡萄的枝叶和果实上。等到溶液干了以后,葡萄上就布满了蓝色的斑点,好像长了霉斑,而且气味特别难闻。那些“小偷”见了这样的葡萄,就会大倒胃口,不愿再来偷吃葡萄了。等到葡萄园主收获葡萄时,只要用水把葡萄上的斑点冲洗干净,葡萄依旧新鲜可口,照样可以大量酿制各种葡萄酒。
19世纪末,法国南部的葡萄园突然流行葡萄霜霉病,当霜霉病菌寄生在葡萄叶上时,叶子好像打过霜一样,布满了白色的斑点,使正在成熟的葡萄萎缩干瘪,葡萄园主纷纷请求科学家研究治理葡萄霜霉病的措施。
法国波尔多大学教授密拉德不但查阅了大量文献资料,还到葡萄园进行了实地观察。他忽然发现,有一处葡萄园依然是果实累累,似乎这一场在葡萄中流行的瘟疫并没有降临此地。于是,密拉德向这位园主请教,问园主是否掌握了与众不同的栽培技术。园主想了很久,最后才告诉教授,为了防止“小偷”来光顾葡萄园,他在葡萄的枝叶和果实上喷洒了硫酸铜和生石灰配成的溶液。密拉德这时才发现,这个葡萄园中的葡萄上确实存在蓝色的斑痕。教授恍然大悟,原来防“小偷”的涂料竟然成了治理葡萄霜霉病的杀菌剂。
密拉德立刻回到大学里的实验室,他在一些葡萄株上喷洒了用硫酸铜和生石灰配成的溶液,另一些则不喷洒溶液。然后,他把人工培养的葡萄霜霉病的病菌移植到葡萄株上。试验的结果表明,洒了溶液的葡萄株安然无恙,而未喷洒溶液的很快就染上了霜霉病。
密拉德终于研究出了杀菌能力极佳的硫酸铜和生石灰配成的杀菌液,为了纪念波尔多城和波尔多大学,密拉德把这种杀菌剂叫做“波尔多液”。这种防“小偷”的涂料终于救活了成千上万个葡萄园并振兴了酿酒业。
通过进一步研究,密拉德还发现,波尔多液对于多种果树、蔬菜的真菌性传染病都有防治作用。从此以后,防“小偷”的波尔多液成了世界上名噪一时的化学杀菌剂。直到现在,果农和菜农们还用到它呢。
食盐的应用
一、盐化工
食盐不仅是生活中的必需品,也是化学工业的基本原料之一。重要化工产品如纯碱、烧碱、盐酸等都是以食盐为原料的,制造化学肥料氯化铵也离不开食盐。化工合成上的重要原料氯气和金属钠也是取之于食盐。由氯加工制得的有机氯产品,象聚氯乙烯塑料(PVC),氯丁橡胶等等更是多种多样。所以化工用盐大大超过了生活用盐,因此,可以说盐化工的发展完全依赖于制盐业的发展。
1.食盐在化工上的利用途径
基本化工原料“三酸”(硫酸、硝酸、盐酸)“两碱”(纯碱、烧碱)中有两碱一酸都是通过食盐而制得。食盐的利用途径大概分为两条:一条是将食盐电解,可制得三种物质:烧碱、氯气和氢气。另一条是将食盐与碳酸氢铵反应得到小苏打(NaHCO3),煅烧后制得纯碱(如图所示)。
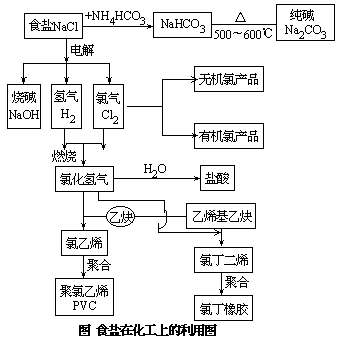
2.食盐的电解
食盐的电解是借助直流电流来进行化学反应的过程。当直流电通过电解槽中的食盐溶液时,就产生了化学变化:氯化钠中的氯离子在阳极上产生氯气,水电离成的氢离子,在阴极上产生氢气,在阴阳极间用石棉做成的多孔隔膜把它们隔开。氯化钠中余下的钠离子与水电离后的氢氧根离子结合形成烧碱(NaOH),随未电解的食盐水流出电解槽,称之为电解液,含NaOH11%~12%,其余为食盐水。电解液经蒸发后析出固体食盐,可得到30%~40%的液体烧碱,如果继续熬煮,最后可得到固体烧碱。总的化学方程式如下:
2NaCl+2H2O ![]() Cl2↑+H2↑+2NaOH
Cl2↑+H2↑+2NaOH
阳极反应:NaCl=Cl-+Na+
2Cl- ![]() Cl2↑
Cl2↑
H2O ![]() H++OH-
H++OH-
阴极反应:2H++2e-=H2↑
电解液:Na++OH-=NaOH
3.氯化氢气的合成与聚氯乙烯的生产
氯化氢气是由氢气与氯气混合后燃烧而制得。由它就可制得盐酸和聚氯乙烯及氯丁橡胶。氯化氢气体极易溶于水,但在溶解过程中大量放出热量,使溶液温度升高,妨碍了氯化氢气的继续溶解,为了得到浓度为35%~38%的浓盐酸,必须用耐腐蚀的石墨冷却器将水溶液温度降下来,才能使氯化氢气更多地溶解而得到浓盐酸。
制造聚氯乙烯所用原料除了氯化氢气外,尚需乙炔。乙炔是由电石水解而得:
CaC2+2H2O→C2H2↑+Ca(OH)2
合成用的原料要求纯度都很高,所以,氯化氢气和乙炔气都必须经过严格的提纯才能合乎要求。因而,在工业上提纯的工序是很多的。
经过提纯后的氯化氢和乙炔气经过一个转化器,内装有浸过氯化汞的活性炭填料,在氯化汞的催化下,乙炔与氯化氢发生加成反应,生成氯乙烯:
![]()
同时也有一些副产物生成,将氯乙烯合成气进一步提纯即得到聚合用的氯乙烯单体。
氯乙烯的聚合在聚合釜内进行。在聚合釜内水为介质,加入明胶为分散剂,偶氮二异丁腈为引发剂(产生自由基),将氯乙烯不断地通入,聚合反应开始,反应是放热的,温度控制在30~50℃之间(视产品规格而定),反应时间约6~38h不等,反应终结时可得到白色聚氯乙烯原粉:
![]()
聚氯乙烯(PVC)在聚氯乙烯原粉内加入增塑剂、稳定剂、填料等可制得各种聚氯乙烯制品,如PVC薄、人造革、电缆料、桶、盆、管材、型材等,广泛用于各个经济部门,是用途最广的塑料之一,可大量节省或代替钢材。
4.纯碱(碳酸钠)的制造与发展
纯碱是基本化工原料之一,制碱是消耗食盐最多的一个部门。生产方法大都是氨碱法,又叫索尔维法,是比利时工业化学家E·索尔维于1866年发明的。
氨碱法是把氨溶于食盐水后,通入二氧化碳,结果生成了碳酸氢钠。分离后加热分解,即得到纯碱(碳酸钠)。
NaCl+NH3·H2O+CO2=NaHCO3+NH4Cl
反应生成的氯化铵可与熟石灰(Ca(OH)2)作用,生成氨气而回收,剩下残渣氯化钙。而由NaHCO3热分解,放出的CO2又可从新与食盐水、氨作用而碳化,原料的利用率较高。又能循环连续生产,因而淘汰了落后的路布兰法。
索尔维1838年生于比利时的勒贝克。儿时体弱多病,未受过正式教育。他18岁时就在其伯父的化工厂里干活,感到科学知识的重要,于是,他就利用业余时间自学了化学和物理,为他以后发明氨碱法奠定了基础。
1863年,年仅25岁的索尔维决心施展自己的才华,实现自己的抱负,于是他和弟弟合作,共同创办了一家化工厂。他走的是一条研制——生产的办厂道路,经过三年艰苦奋斗,终于发明了氨碱法。实现了生产连续化,降低了生产成本,提高了食盐利用率,在提高产品质量方面更为显著,他们生产的产品外观洁白而又纯净,被誉之为“纯碱”,从此,碳酸钠又有了一个新名——“纯碱”。
索尔维的氨碱法的优越性得到世界的公认,并很快在英、法、德、美等国推广普及。1920年,范旭东与著名化工专家侯德榜合作,在天津塘沽创办了我国第一家制碱厂——永利碱厂,历时9年,克服了西方的技术封锁,生产出了在国际博览会上获金奖的三角牌纯碱。侯德榜同时也看到索尔维法的缺点是产生了大量废渣——氯化钙。为此,他终于发明了著名的侯氏制碱法,为制碱工业作出了巨大贡献。
二、食盐的其他应用
食盐在食品工业上用作调味品,因为人类在生理上对咸味有强烈的需要,而且氯化钠也是维持人体内渗透压平衡的主要成分。没有糖人还可以活,没有盐活着就很困难,四肢无力,还会出现消化不良,精神失常,以致于死亡。
此外,在食品加工中,食盐可做防腐剂。腌鱼、腌肉、腌菜是我国的传统食品加工方法之一,既防止了腐败,又制得了美味食品。因为食盐有渗透作用,可使肉类、蔬菜脱水,还可使细菌细胞内的水分渗出而死亡,因而起到防腐作用。
畜牧业也离不开食盐,一头牛每天需要30~40g食盐一匹马每天需要10~15g食盐。牲畜吃了盐可以膘肥体壮、耐寒耐劳、防止疾病发生。
食盐在制皂和染料工业常作盐析之用,矿业的氯化、焙烧;钢铁的表面处理;皮革业的皮毛保存;窑业的彩釉配制;酸性白土变活性白土;或利用石英砂和焦炭制金刚砂等均要使用食盐。
食盐用途之广难以尽述,而随着科技的发展,新用途还将不断出现。因此,食盐在国民经济上有着特别重要的意义。