 设为首页
设为首页
 加入收藏
加入收藏
教材分析
1.教材中介绍了氯化钠、碳酸钠和硫酸铜三种重要的盐,主要意图是为了密切地联系生产和生活实际。教材还在相应的位置穿插讲授了结晶水、结晶水合物、结晶水合物式量的计算,风化、潮解及碳酸根离子的检验等。这些也都是工农业生产和生活上不可缺少的常识性知识和技能。
2.有关食盐用途方面,日常生活中的食用和医用生理盐水等都是学生比较熟知的,因此可把重点放在它的工业用途上。通过NaCl的存在、储量、组成成分,都可以说明它是一种重要的化工原料,可以用来制造钠和钠的化合物,如NaOH、Na2SO4、Na2CO3,还可以制氯气、氯化氢(盐酸)等。其中Na2SO4是芒硝的主要成分,而Na2CO3是口碱的主要成分。
3.在讲碳酸钠时,除了介绍结晶水、结晶水合物、风化等概念外,还以实验说明了风化的过程。并且还介绍了碳酸钠与盐酸的反应及其产物,实验现象等。这样一则可以加深对碳酸盐性质的印象,另一方面也就初步学会了碳酸根离子的检验方法。
4.硫酸铜在农业生产中用途很大,它的俗名“蓝矾”及“胆矾”在日常生活中被广泛应用。教材中介绍了硫酸铜在农业上及工业上的应用。如制“波尔多液”以及精炼铜、镀铜。
5.本节教材中的家庭小实验取材简单,简便易做。如食盐、明矾、纯碱为家庭常用,且并不需要特殊的玻璃仪器。
6.本节重点:
氯化钠的用途、碳酸钠的用途、硫酸铜的用途
结晶水合物式量的计算
碳酸根离子的检验方法
盐的化学性质
复分解反应的条件
本节难点:
复分解反应发生的条件
教学建议
教材中介绍了氯化钠、碳酸钠和硫酸铜三种重要的盐,主要意图是为了密切地联系生产和生活实际。教材还在相应的位置穿插讲授了结晶水、结晶水合物、结晶水合物式量的计算,风化、潮解及碳酸根离子的鉴别等。这些也都是工农业生产和生活上不可缺少的常识性知识和技能。
学生对这三种盐比较熟悉。建议教学采取课前预习,课上讨论、实验、教师重点小结的方法。课上讨论时,可以按照氯化钠、碳酸钠、硫酸铜的顺序,针对每种物质的化学式、俗名、色态、特性和用途等,结合教材列举跟生活中接触到的有关事例,充分让学生讨论并配合做碳酸根离子鉴别和硫酸铜结晶水的实验,最后由教师指出重点。
结合碳酸钠晶体的化学式,教会结晶水合物式量的计算方法,并与下面的硫酸铜晶体结合在一起,单独开一个小专题:“结晶水合物式量的计算”。
让学生自己动手做“碳酸根离子的检验”的实验,并与全班同学结合溶液的有关知识展开讨论:结晶水合物是属于纯净物还是混合物?晶体内是不是都含有结晶水,最后在教师引导下得出结论。
盐化学性质的实验都是用试管就可以做的,选用边实验、边讨论、边引导的教学方法。并且这些实验尽量让学生动手做,每种性质多选几个实验,以培养学生的动手能力、观察能力和书写化学方程式的技能。每做一个实验,都要引导学生观察实验现象,分析反应实质。每做完一组实验,都要在学生讨论的基础上,找出反应规律的方法,突破重难点的学习。
复分解反应的发生条件,在前面讲酸、碱、盐性质时,学生已有初步认识。本节课是在学生已有的知识基础上,总结复分解反应的基本规律。前面做过的复分解反应的实验,都是能够发生的,此时再补几个不能发生的,分析为什么不能发生、这时,再联想、对比以前的为什么能够发生,关键是反应前在溶液中存在的自由移动的离子,混合后离子间结合成不能自身移动的沉淀物,逸散出气体或生成极难电离的水。使那些离子脱离了反应的体系,因而使复分解反应能够向生成这些物质的方向趋于完成。
关于复分解反应发生条件的教学建议
关于复分解反应发生条件的教学,可采用实验、复习和讨论相结合的方法。
教学中可通过如下实验加强学生对复分解反应发生的条件的了解。
往四支试管里分别加入硝酸银溶液、碳酸钠溶液、氢氧化铜粉末和硝酸钾溶液,然后分别滴加盐酸,观察并讨论哪个试管里发生了化学变化,根据什么现象判断它发生了化学变化。
要使学生理解:硝酸银与盐酸的化学反应之所以能进行是因为产生了沉淀;碳酸钠与盐酸能反应是因为产生了气体;氢氧化铜与盐酸能反应是因为有水生成;盐酸与硝酸钾溶液不反应。分析了这个实验之后,写出化学反应方程式:
![]()
![]()
![]()
讨论它们都属于什么反应类型,并做出如下结论:生成沉淀、生成气体或生成水是复分解反应发生的条件。可做几个练习,例如:
下列哪几组物质在水溶液里能发生复分解反应:
(1) ![]() (2)
(2) ![]()
(3) ![]() (4)
(4) ![]()
(5) ![]() (5)
(5) ![]()
讲授时不要把第四个实验 ![]() 跟其他三个实验一起分析。因为在没学习判断复分解反应能否进行的条件之前,学生会轻率地写出
跟其他三个实验一起分析。因为在没学习判断复分解反应能否进行的条件之前,学生会轻率地写出 ![]() 的“化学方程式”,认为生成了新物质
的“化学方程式”,认为生成了新物质 ![]() 和
和 ![]() 。要想扭转这种错误想法,势必要花费更大的精力。
。要想扭转这种错误想法,势必要花费更大的精力。
关于氯化钠的教学建议
有关食盐用途方面,日常生活中的食用和医用生理盐水等都是学生比较熟知的,因此可把重点放在它的工业用途上。通过 ![]() 的存在、储量、组成成分,都可以说明它是一种重要的化工原料,可以用来制造钠和钠的化合物,如
的存在、储量、组成成分,都可以说明它是一种重要的化工原料,可以用来制造钠和钠的化合物,如 ![]() ,还可以制氯气、氯化氢(盐酸)等。
,还可以制氯气、氯化氢(盐酸)等。
尤其应该着重讲一讲,盐和食盐是不同的。有的人认为盐和食盐一样,是盐就能够食用,误将工业盐(如 ![]() 等)用于烹调,这是很危险的。过去曾经发生多起食物中毒事件,造成严重的危害。从而也说明学习科学知识对提高公民素质的重要意义。
等)用于烹调,这是很危险的。过去曾经发生多起食物中毒事件,造成严重的危害。从而也说明学习科学知识对提高公民素质的重要意义。
关于碳酸钠的教学建议
讲碳酸钠时,除了介绍结晶水、结晶水合物、风化等概念外,还可以联系在碳一章学过的碳酸钠、碳酸钙和盐酸的反应,并在本节课上重做这个实验。这样一则可以加深对碳酸盐性质的印象,另一方面也就初步学会了鉴别 ![]() 的方法。
的方法。
还应着重指出 ![]() 虽然俗名为纯碱,但它不属于碱类而属于盐。纯碱名称的来源是它的水溶液呈碱性,为此可以演示或让学生实验,观察碳酸钠水溶液里滴入酚酞试液时的颜色变化。碳酸钠的用途多与它具有碱性有关,如制肥皂、洗涤剂以及在纺织工业上都是利用它的碱性。
虽然俗名为纯碱,但它不属于碱类而属于盐。纯碱名称的来源是它的水溶液呈碱性,为此可以演示或让学生实验,观察碳酸钠水溶液里滴入酚酞试液时的颜色变化。碳酸钠的用途多与它具有碱性有关,如制肥皂、洗涤剂以及在纺织工业上都是利用它的碱性。
在计算 ![]() 式量时,应强调指出“·”不是数学上的“乘号”,而是表示碳酸钠晶体是含有一定量结晶水,它的式量是
式量时,应强调指出“·”不是数学上的“乘号”,而是表示碳酸钠晶体是含有一定量结晶水,它的式量是 ![]() 的式量跟
的式量跟 ![]() 式量“相加”的和。
式量“相加”的和。
教材中增加了我国著名化学家侯德榜的肖像,教师可简单介绍有关侯氏制碱法及其伟大意义,以加强爱国主义教育。
关于盐的化学性质的教学建议
盐的化学性质的提法与酸、碱的提法不同,因为酸、碱具有通性,而盐的化学性质规律性不明显,所以,讲课时不可提盐的通性。对盐的每个化学性质来说,都要强调它的反应条件并做具体分析,为讲复分解反应打好基础。
对于盐跟金属的置换反应,一要强调盐必须是可溶性盐,二要强调该金属要比组成盐的金属更活泼。在学习盐跟金属的反应时,教师应估计到学生常犯的三种错误:一是不考虑盐是否溶于水,该金属是否比组成盐的金属活泼,而是见到盐与金属就不假思索地写出生成另一种盐和另一种金属的化学方程式。克服这个错误的办法是,先做实验使学生看到是否发生反应,再讲道理,然后通过做练习来巩固。二是把金属和酸发生置换反应的规律简单套用到金属和盐的反应中,根据金属活动性顺序中氢以前的金属可以置换氢以后的金属,就错误地得出氢以后的金属不能发生置换反应的结论。为了纠正这种错误,做好[实验8-33]铜和硝酸汞溶液发生置换反应就特别重要。要让学生看清实验现象,并讲清道理,指明金属和盐反应不受氢前氢后的限制,这点不能简单地照搬金属和酸反应的情况。学生常犯的另一个错误是喜欢选用活泼金属如钾、钠和盐溶液按一般规律组成置换反应,改正这种错误最好是做个实验,使学生亲眼看到金属钠放入硫酸铜溶液里发生的不是下列反应:
![]()
而是发生下列反应:
![]()
![]()
生成氢气和氢氧化铜。如遇到上述错误,教师应有所准备,必要时给予引导,但不要引申。
讲盐跟碱的反应时,要强调两者都应是可溶性的,生成物之一是沉淀,反应才能进行。这种反应也是制碱的一种方法。这里要讲明制碱的思路:要制碱的金属阳离子由含该金属阳离子的可溶性盐提供、 ![]() 由可溶性碱如
由可溶性碱如 ![]() 提供,一般使用
提供,一般使用 ![]() 。如制
。如制 ![]() 可用下述方法:
可用下述方法:
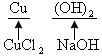
或 ![]()
或 ![]()
![]()
关于盐的物理性质的教学建议
掌握盐的溶解性规律是学习盐的化学性质和复分解反应的关键。先学习怎样查用教材附录部分的物质溶解性表,让学生从表中找出盐的溶解性规律,并帮助学生掌握归类记忆的窍门。
钾盐、钠盐、铵盐、硝酸盐都溶,
盐酸盐除氯化银,硫酸盐除硫酸钡外其他都溶,
碳酸盐、磷酸盐除钾盐、钠盐、铵盐溶,其他不溶。
重要的是要加强练习,务必使学生逐步达到熟悉的程度。
演示实验建议
1.[实验8-30] ![]() 的鉴别实验可以增做
的鉴别实验可以增做 ![]() 等加盐酸以及硫酸钠加盐酸的实验。从中总结出
等加盐酸以及硫酸钠加盐酸的实验。从中总结出 ![]() 的鉴别方法,这样的对照实验可以使学生加深印象。
的鉴别方法,这样的对照实验可以使学生加深印象。
2.[实验8-32]做锌片、铝丝与硫酸铜溶液的置换反应时,要先用砂纸把锌片、铝丝磨光。硫酸铜溶液不能太稀,用0.5mol/L的浓度为宜。
3.[实验8-33]铜与硝酸汞溶液的置换反应,要先用砂纸把铜丝磨光。用2%的硝酸汞溶液为宜。
硝酸汞和被置换出附在铜丝上的汞都有毒,为了防止污染,实验完毕后硝酸汞溶液要回收保存,下次实验还可使用(必要时,可再加些硝酸汞以增大硝酸汞的浓度);利用汞和硫易发生化合反应生成不溶性 ![]() ,可把附有汞的铜丝收集起来,埋在硫粉里,这样可以减少汞的污染。
,可把附有汞的铜丝收集起来,埋在硫粉里,这样可以减少汞的污染。
4.可以增加盐和盐反应的实验,如硝酸银溶液和氯化钠溶液的复分解反应、氯化钡溶液和硫酸钠溶液的复分解反应等(硝酸银溶液用0.5%的水溶液,氯化钡、硝酸钠、氯化钠溶液用2%的水溶液)。
5.教师在课前应配制好波尔多液,课上演示实物以加强教学的直观性、加深同学对硫酸铜用途的认识。制得的波尔多液最好把它派上用场,不应随意倒掉。这对学生既是理论联系实际的教育,也是励行节约的教育。