 设为首页
设为首页
 加入收藏
加入收藏
1999年度诺贝尔化学奖
飞秒照相机快门 获得者:Ahmed H.Zewail
(摘自《科学》)
在科学领域,追求化学反应更精微细节的能力一直是人们不懈的探求目标之一。这种能力将帮助探求者解决基础的问题。
例如:为什么一些反应发生而另一些反应却不发生,为什么化学反应的速率和产物与反应过程的温度有关。
困难在于反应时速度极快。眨眼之间(1/4秒),苯和碘分子可以发生3330亿次生成原子碘及其他产物的反应。
70年代后期以来,Ahmed
H.Zewail开始用短激光脉冲照射反应过程中的分子和原子,以帮助实时解释动力学。
在反应过程中,过渡状态的分子或原子所表现出的特性既不是反应物,也不是产物。这些分子或原子吸收或反射任何照射到它们上的光,改变入射光和光谱使之产生具有特征频率的光。
过渡状态公维持了10到100飞秒,所以探测它们的激光脉冲必然是非常的短。激光具有这种脉冲的能力发现于80年代中期。Zewail和他的合作者立刻意识道了这一发现的实用价值。
1978年首先用于氰化碘(ICN),他们第一次能够观察得出分子离解作用的看到分子分裂成碘和氰,甚至看到碎片互相分离开去。
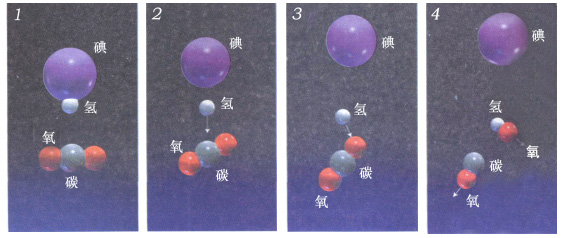
上图: 碘化氢分子与二氧化碳反应产生一氧化碳、氢氧化物和碘,这个过程于80年代后期被Ahmed H.Zewail和他的同事探测和记录。使用无数的极短激光脉冲,研究者能接连跟踪系列事件(1~4),而且能得知单独的分子和原子的运动
在一个典型的实验里,Zewail用泵脉冲引发了一种反应(泵脉冲把能量加到反应物上)。
几飞秒后,第一个脉冲探针作用于分子,接下来在整个反应期间每10飞秒左右脉冲照射一次,达几千次之多。每个脉冲探针光谱的变化可以揭示任何化学键及活化能级以及原子和分子的运动。
研究者现在使用Zewail的技术在如下这些现象中提供更详细的洞察力,如催化、光合作用以及当用眼睛扫视照片时在视网膜视杆里光驱动的分子传递是如何发生的。
至于Zewail自己,他说:“我们的最新工作是实时了解生物系统内分子的结构——即结构是如何从一种构型变成另一种构型的。”
作为在这一领域的首次尝试,他与同事们检测了从乙烷获取乙烯反应的动力学。更长期的目的是研究蛋白质分子——生命存在的基石——的动力学。
Zewail相信,精确使用熟练设置的脉冲将最终可能改变分子。研究生们注意:这很可能是另一个诺贝尔奖所在。
化学反应动力学研究的大师
-------谢苗诺夫
尼古拉依·尼古拉那维奇·谢苗诺夫是杰出的苏联化学家,是苏联化学界的学术带头人之一,是苏联建国后第一个获得诺贝尔奖的学者。
1896年4月15日,谢苗诺夫出生于萨拉多夫。少年时代受过良好的教育,早在中小学阶段,他就对物理学和化学有着浓厚的兴趣,他学习认真,成绩优异。
1917年,年仅21岁的谢苗诺夫,以优异的成绩毕业于彼得格勒大学数学力学系,他是著名的苏联物理学家约飞的学生和助手。这段大学生活为他打下了良好的数学和物理学基础,也为他以后在理论化学方面的深入研究创造了条件,使他的知识结构优于一般化学家。
1920年到1930年,谢苗诺夫在约飞创办的列宁格勒技术物理研究所工作,被任命为列宁格勒化学物理所所长,同时,在列宁格勒工学院兼职任教,并从1928年起担任该学院的教授。
1929年,他被选为苏联科学院的通讯院士,1932年彼选为正式院士。1944年,苏联科学院化学物理所迁到了莫斯科,作为该所所长的谢苗诺夫。也同时迁居莫斯科,并担任了以罗蒙诺索夫名字命名的国立莫斯科大学的教授。
谢苗诺夫因为在科学上的杰出贡献,曾多次获奖,许多外国科学院和科学团体把他选为院士或会员。他的专著《链式反应》和《论化学动力学某些问题和反应能力》等被各国翻译出版。这位苏联学者在全世界享有极高的声望。
1956年,瑞典科学院和诺贝尔基金会,为了表彰谢苗诺夫和英国化学家欣谢乌德在化学反应动力学和反应历程研究中所取得的成就,让他两人分享了该年度的诺贝尔化学奖。谢苗诺夫是获得这种最高国际科学奖的第三位俄国学者,也是苏联建国后,第一位荣获这种奖的科学家。
谢苗诺夫的科研工作,几乎全部用来研究化学反应历程和化学动力学问题,他对链式反应历程做了深入而全面的研究。链式反应的发现,标志着理论化学的研究进入到一个新的阶段。传统的化学,只注重反应物和产物的研究,对于反应物如何转变成产物,转变的复杂机制和过程则很少注意。
德国化学家博登斯但在1913年曾提出链式反应的概念,用以解释氢和氯反应生成氯化氢的复杂过程,他认为,在这个反应过程中会生成某种“中间体”。但是,博登斯但提出的“链反应”和“中间体”说,还是一种假设和猜测。
德国物理化学家能斯特在1916年,提出了氯化氢生成的链反应机理。他认为,在这个反应过程中,会形成作为“中间体”的自由基。
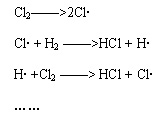
在以上链反应提出以后,有许多学者对此进行了进一步的深入研究。例如,威加特1922年曾用实验证明了链反应的存在,1923年克拉麦斯把链式反应的机理用于光化反应的研究。但是,在1927年以前,链反应在化学上还不具有普遍的意义,它仅仅被用来解释某些个别反应。
1927年以后,谢苗诺夫系统地研究了链反应机理,他在此项研究中,曾试图对反应历程进行数学描述。
谢苗诺夫认为,化学反应有着极为复杂的过程,在反应过程中有可能形成多种“中间产物”。在链式反应中,这种“中间产物”就是“自由基”,“自由基”的数量和活性决定着反应的方向、历程和形式。链反应不仅有简单的直链反应,还会形成复杂的“分支”,所以,谢苗诸夫还提出了“分支链式”反应的新概念。
谢苗诺夫指出,链式反应有着普遍的意义和广泛的实用价值。在理论上,谢苗诺夫广泛地研究了各种类型的链式反应,提出了链式反应的普遍模式,他还试图用这种反应机理解释新发现的化学振荡现象。
在应用上,谢苗诺夫把链式反应机理用于燃烧和爆炸过程的研究,揭示出燃烧和爆炸的联系和区别,并指出,燃烧是缓慢的爆炸,爆炸则是激烈的燃烧,他还指出了燃烧和爆炸的机制。
谢苗诺夫通过研究,丰富和发展了链式反应的理论,奠定了分支链式反应的理论基础和实验基础。他认为,不仅在链式反应的开始,而且在反应过程中,化学反应系统都会不断地产生活化质点,这些活化质点,会对反应进程产主影响,会使反应中出现许多分支,如同树叉一样,不断地分支扩展。活化质点的状态,还会影响到反应的进展情况,会使某些反应速度增大,而使另一些反应过程减漫或难以进行。
谢苗诺夫用大量的实例证明,对化学反应过程和化学反应动力学的研究有重大的意义。他认为,化学反应过程是化学作为更复杂的科学区别于物理学的基础和标志。在化学过程中,物质要发生极为复杂的变化,而在物理过程中,物质的本性则没有发生或很少发生变化。因此,化学过程是比物理过程更复杂的过程。
谢苗诺夫认为,在化学史上,在相当长的一段时间中,化学家只注重于化学的始态和终态的研究,而忽视了过程,使化学动力学和化学过程的研究,落后于其他领域的研究,例如,对化学过程的研究就不如对化学结构研究深入。他指出:“研究化学历程的理论的发展,比研究化学结构的理论的发展要曲折、复杂、困难得多。”
谢苗诺夫在荣获诺贝尔奖金时,发表了著名的演讲,他在演讲中十分强调地指出:“在化学理论的研究方面,要大大加强对化学动力学和化学复杂过程的研究,从而进一步弄清化学反应历程,对化学反应逐步实现定量化。”他认为,“实现对各种化学反应速度和化学反应方向的精确定量的控制,这是化学理论研究的长远任务。可惜,到目前为止,在化学工艺的理论方面,还远远落后于无线电技术、电子学和原子物理学等其他方面的研究,在这些方面,工。艺过程在相当大的程度上建立在理论预见和定量计算的基础上。”为了使化学也和其他科学一样,实现严密的定量化,“链式反应理论“为解决这一问题,迈出了第一步。”
谢苗诺夫在创立链式分支反应理论时,曾深入研究和采用了前人的研究成果,他认真考察和分析了历史上各位著名化学家提出链式反应的思想,同时,他还把这种研究和化学实验与化学工飞结合起来,成为理论联系实际的光辉范例。谢苗诺夫的链式分支反应理论,能够正确地说明链式反应如何开始,如何进行以及反应过程中的复杂变化和可能的方向。同时,还能得出关反应速度的许多有价值的绪论。在谢苗诺大的链式分支反应理论的指导下,甚至还能做到调控反应过程,使化学反应在希望的方向上进行,所以,他的这一辉煌成果,不仅可用来指导完善现有的化学工艺,而且还可以指导研究新的化学工艺。因此;化学家们一致认为:“谢苗诺夫的分支链式反应理论是理论化学研究的一个里程碑。”
谢苗诺夫的理论深化了人们对复杂化学过程的认识,揭示了化学过程不同于物理过程的本质,指明了化学反应复杂过程的过程和机理,这在认识论和方法论上也有重大的意义,谢苗诺夫及把理论研究和应用研究有机地统一起来,促进了科学的进步和技术的发展。
谢苗诺夫倡导各种不同专业的科学家互相协作,他认为,化学理论的研究,应当和其他自然科学互相联系、互相渗透、要积极采用其它自然科学的理论方法,特别要注意积极采用数学和物理学的理论方法。他还指出,各种专家协同研究重大课题,对新技术革命和科学的未来具有重大意义。
作为一个世界著名的科学家,谢苗诺夫曾多次强调科学要为人类的幸福和社会的进步服务,主张防止把科学成果用于危害人类的安全。他在荣获诺贝尔奖金时发表的演讲的最后,向全世界科学家们呼吁,“世界科学家共同努力,要使科学为世界的进步利益和人类的幸福,做出积极贡献。”
谢苗诺夫还是一位出色的教育家,他的教育思想和他的科学思想是一致的,主张理论联系实际。他要求他的学生和其他青年科技工作者,无论是做教学工作的还是敞研究工作的,都不应把自己死死地限制在课堂上或者实验室里,要做到理论联系实际,要努力解决国家和民族最急需最紧迫的问题,要使科学成果迅速转化为直接生产力。
硫代硫酸钠与稀硫酸反应
1.实验目的
了解和掌握:①在其它条件不变时,增加反应物的浓度,可以增大反应速率;②升高温度,加快化学反应速率。
2.实验原理
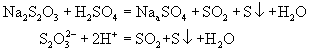
由于反应缓慢生成不溶于水的硫;使溶液出现乳白色浑浊现象,根据出现浑浊需时间的长短,判断反应进行的快慢。
3.实验步骤
(1)在A,B两个试管里分别加入0.1mol·L-1的硫代硫酸钠溶液10mL、5mL,在B试管里再加入5mL蒸馏水。另取两支试管,每支试管各盛0.1mol·L-1H2SO4溶液10mL。然后同时倒入上述A,B两支试管里,注意观察,发现A试管首先出现浑浊,然后B试管出现浑浊。
(2)取A,B两支试管,各加入0.1mol·L-1Na2S2O3溶液10mL,另取C,D两支试管,各盛0.1mol·L-1H2SO4溶液10mL。
然后将A,C和B,D试管插入冷水、热水里,一会后,分别将A与C,B与D溶液混合,发现在热水里浸泡的B,D混合液首先出现浑浊,而在冷水里浸泡的A,C混合液后出现浑浊。
4.实验小结
(1)化学反应速率通常用单位时间(如每s,min,h等)内反应物浓度的减少或生成物浓度的增加来表示,单位是mol·L-1·min-1或mol·L-1·s-1。
(2)在整个化学反应过程中,反应不是以同样的速率进行的。我们所描述的反应速率是指某段时间内的化学反应的平均速率,而不是瞬时速率。化学反应速率不取负值。
(3)同一化学反应里,不同物质反应速率之比等于化学方程式中各物质的系数比。如:
![]()
![]()
反应物浓度对反应速率的影响
——盐酸与硫代硫酸钠的反应
【实验原理】
Na2S2O3(aq)+2HCl(稀)==SO2(g)+S(s)+2NaCl(aq)+H2O
反应缓慢生成不溶于水的硫;使溶液出现乳白色浑浊,通过观察溶液的浊度来估测反应速率。改变硫代硫酸钠的浓度而保持盐酸的浓度不变,通过测定溶液达到同等浊度时所需的时间来比较反应物浓度对反应速率的影响。
【实验步骤及现象】
将8 g硫代硫酸钠溶解在200 mL蒸馏水中配制成溶液。如下图所示,取50
mL配好的硫代硫酸钠溶液倒入100
mL烧杯中,将烧杯放在画有黑色十字的纸上,向烧杯中加入5
mL 2mol/L的盐酸,立即开始记时,边搅拌边从溶液上方观察溶液的浊度,透过浑浊的硫,当看不见黑色十字时,记录时间。
分别将30 mL、20 mL、10 mL配制好的硫代硫酸钠溶液用蒸馏水稀释至50 mL,保持盐酸浓度不变,重复以上操作,随着硫代硫酸钠溶液稀释程度的加大,看不到黑色十字的时间变长,这表明反应物的浓度越小,反应所需时间越长(反应速率越小)。以硫代硫酸钠溶液中溶质的浓度对时间作图。
