设为首页
设为首页
 加入收藏
加入收藏
教材分析:
本节教材分为三部分。
第一部分是氧族元素。由于有原子结构和元素周期律的知识,因此应该充分发挥理论知识的指导作用。教材采取讨论的方式来安排氧族元素的性质变化规律的学习。学生通过观察氧族元素在周期表中的位置和氧族元素性质的表格,从原子的核电荷数、电子层数、原子半径、最外层电子所受作用力的大小、非金属性和金属性等几个方面来讨论这一族元素性质的变化。由于学生在“卤素”一章曾经比较详细地讨论过氟、氯、溴、碘与氢气反应的难易及其生成的氢化物的稳定性。在“原子结构 元素周期律”一章,又学习了元素非金属性的强弱与生成气态氢化物的难易程度以及氢化物的稳定性的关系,因此本节在介绍氢化物和最高价氧化物对应的水化物的有关知识时,教材以硫为例,然后迁移到氧族的其它元素。
第二部分是臭氧的有关知识及同素异形体的概念。这是新教材新增加的内容。教材从正反两个方面介绍臭氧,使学生全面地看待问题,受到辩证唯物主义观点的教育。
第三部分是过氧化氢,教材只是侧重用途。
本节教学重点:原子结构与元素性质的关系,氧族元素性质的相似性和递变规律。
难点:原子结构与元素性质的关系,氧族元素性质的相似性和递变规律。
关于硫单质的氧化性和还原性的教学建议
学生在第一章就学习了有关氧化还原反应的知识,在后面的教学中教师应有意识的复习、通过练习加深学生对知识的认识,把学过的知识加以利用,指导后面的认知活动,这样学习才有意义。对于单质,我们只研究它的氧化性、还原性和特性。
硫与金属、氢气等还原剂反应表现出氧化性:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
值得注意的是,硫与可变价的金属发生反应时,生成的往往是较低价态的金属硫化物,这说明硫的氧化性不是很强,是一种弱氧化剂。
与氧气、浓硫酸、浓硝酸等强氧化剂反应,则表现出还原性:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
因为硫单质中硫元素的化合价处于中间价态,可升可降。硫单质的化学性质是氧化性和还原性的对立统一:
![]()
![]()
![]()
![]()
![]()
但硫单质的氧化性与还原性不是等同的,一般情况下,硫单质表现出氧化性,只有与氧化性比硫强的物质反应时才表现出还原性。
单质硫还可以与强碱发生化学反应:
![]()
![]()
![]()
在反应中,单质硫中一部分升价,一部分降价。
硫是一种较活泼的非金属单质。通过对硫单质的化学性质的正确认识可以更加科学地把握氧化还原反应规律。
运用对比法讲好硫的性质
氧、硫这两种元素的原子最外层电子数相同,都是6个电子,化学性质相似
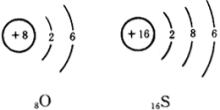
从已知氧气的化学性质出发,学生很容易学习硫的化学性质。因此教师在教学中应注意和氧进行对比。硫跟氧相似,可以跟 ![]() 、
、 ![]() 、
、 ![]() 等多种金属化合,生成金属硫化物
等多种金属化合,生成金属硫化物
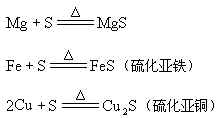
从上述反应看,硫是得电子的物质,表现出氧化性。硫的氧化性与氧相比较弱,这表现在跟铁、铜等变价金属化合时,生成低价金属硫化物。这是因为硫的原子半径比氧大,得电子要难些的缘故。
硫跟氧性质相似,还表现在跟氢气发生的化合反应上
![]()
这个反应同样显示了硫的氧化性。
当硫与比它氧化性强的氧气发生氧化还原型的化合反应时,硫则是失电子的物质,表现出它的还原性
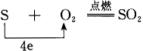
综上所述,硫的化学性质就是氧化性和还原性的对立统一。当遇金属、氢气等还原剂时,硫表现出氧化性;当遇氧气等强氧化剂时,硫又表现出还原性。但是,硫的氧化性和还原性并不是等同的。硫作为一种较为活泼非金属,在一般情况下,主要表现出氧化性;只有在遇到比硫还强的氧化剂时,才表现出还原性。对硫的化学性质的全面、准确掌握,正是基于对氧化还原规律的正确运用。
知识的网络化
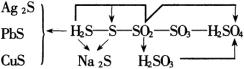
有的同学认为元素化合物部分的知识内容庞杂凌乱,难记难学。其实,每一个知识点都是处在他所固有的系统之中而不是孤立存在的。无论从事物普遍联系的哲学观点,还是从使知识条理化、变得易于掌握的角度,我们都有必要将物质之间的联系总结出来,勾勒出知识的网络,然后在这样的网络结构中考察和认识具体物质的性质。教师在教学中应有意识的培养学生总结归纳知识的能力,使之形成网络。例如:硫元素及其化合物的知识结构可以从以下几个角度去总结:

这一系统中横向的变化中有化合价的变化,是氧化还原反应系列;而纵向的变化中没有化合价的变化,是酸碱反应系列。
3.物质之间转换关系系统