 设为首页
设为首页
 加入收藏
加入收藏
教材分析:
本节教材有以下两个特点:(1)对与初中知识有交叉的内容,有的是采取综合列表的方法,有的则是采用讨论的方法,让学生通过讨论并运用初中学过的知识,从中总结出规律性。(2)元素周期律的导出以理论为指导,以事实为依据。旧教材中的元素周期律知识,完全是理论的推导。新教材中的元素周期律知识的得出,不仅有理论推导,还通过比较同周期元素的性质对理论推导进行了验证。而且,理论推导也从陈述式改为由学生自己进行探索的方式进行。至此为止学生已经学习了氧、氢、碳、铁等元素及其一些化合物,还学习了碱金属、卤素两个元素族的知识,初步学习了原子结构的理论知识。在这个基础上,引导学生探索元素性质和原子结构的关系,揭示元素周期律的实质,是十分必要的。为了增强启发性,教材不是直接给出元素周期律,而是通过课堂讨论和边讲边实验,引导学生对大量数据和事实进行分析,总结归纳出周期律。这样对于培养学生的逻辑推理能力十分有利。
本节教学重点:原子的核外电子层排布和元素金属性、非金属性变化的规律。
本节教学难点:元素金属性、非金属性变化的规律。
从多个层次理解元素周期律
元素周期律是研究元素间的相互联系和变化规律。它的具体内容是:元素的原子结构和性质随着原子序数的递增而呈现周期性变化的规律。
对于元素周期律,应从本质的、感性的、辩证的、不同层次、不同角度去理解。
从本质上看,元素周期律首先是原子结构的周期性变化。从1~18号元素,随质子数递增最外层电子数、原子半径都呈周期性变化。最外层电子数和原子半径直接影响着元素的性质,因此原子结构的周期性变化决定了元素性质的周期性变化。例如元素化合价特别是最高正价随着质子数的递增,而呈现+1至+7的变化规律。元素的金属性、非金属性也随着原子序数的递增而呈现规律性变化。这体现了结构决定性质。
从感性上理解元素周期律。在学习元素周期律之前,已经学习了卤素、碱金属2个主族元素族。具备了一定的元素化合物知识,在理解元素周期律时,以这些知识为材料,将已学元素化合物知识和新学的基本理论有机地结合起来,既能更好地理解理论,又能进一步认识元素化合物。例如,元素周期律指出元素的原子结构随着原子序数的递增而呈现周期性的变化。如何变化?请看三族元素卤素从F到At,原子结构如下:
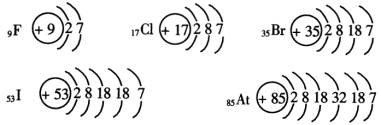
随着原子序数从9到85,原子核外电子层数从2层到5层,呈递增趋势(原子的半径逐渐增大),最外层电子数都为7个。
作为金属族的代表物碱金属族也有相同的规律。原子结构如下:
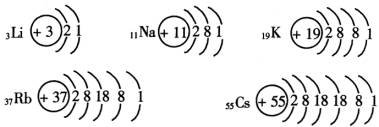
从3号Li到55号Cs,随着原子序数从3到55递增,原子核外电子层数递增,从2层到6层。原子的半径也逐渐增加,最外层电子数都相同,是1个电子。
由此可见,用丰富的实际知识去理解一个新学的理论规律,便于掌握这一理论,从而也巩固了已学的实际知识。
要辩证地理解元素周期律。元素周期律指出元素的原子结构和性质都随原子序数的递增而呈现周期性变化。所谓“周期性变化”如何理解?结合周期表来看,无论是同一周期元素,还是同一主族元素,原子的核外电子排布、原子半径、元素的化合价,以及元素的金属性、非金属性都呈现一定的周期性变化。但是,事物都有两方面。在应用元素周期律时,既要考虑元素族的通性,又要考虑到元素间的差异性,不可一味照搬照套。正像化学中常说的一句话“结构决定性质”。当同族元素的原子结构相同时,决定了元素性质的相似性;当同族元素的原子结构出现差异性时,元素的性质就呈现递变性。元素周期律正是指元素性质的相似性和递变性的辩证统一。