 设为首页
设为首页
 加入收藏
加入收藏
扩展资料
关于漂白粉
1774年,舍勒发现氯气的同时也发现了氯水对纸张、蔬菜和花具有永久性的漂白作用。1785年法国化学家贝托雷(Claude louis Berthollet)提出把漂白作用应用于生产,并注意到氯气溶于草木灰水形成的溶液比氯水更浓,漂白能力更强,而且无逸出氯气的有害作用。1789年英国化学家台耐特(Smithson Tennant)把氯气溶解在石灰乳中,制成了漂白粉。
现在工业上还是采用把氯气通入消石灰或石灰乳的方法制取漂白粉。消石灰要含略小于1%(质量分数)的水,因为极为干燥的消石灰是不跟氯气反应的。生产漂白粉的反应过程比较复杂。
漂白粉是混合物,有效成分是
![]() 。商品漂白粉往往含有
。商品漂白粉往往含有
![]() 、
、 ![]() 、
、 ![]() 和
和 ![]() 等杂质。
等杂质。
漂白粉的质量是按它的“有效氯”以及它能长时间保持有效氯的能力来决定的。有效氯是根据它同盐酸作用时产生的氯气的量来计算的。漂白粉的氧化能力(漂白作用主要是由氧化反应引起的)是用有效氯的质量分数来表示的,工业品漂白粉一般含有效氯35%,高的可以达到40%。
扩展资料
氯气的毒性
氯是具有强氧化性、腐蚀性的极毒性气体,重要特性如下:
1.物理性质
|
项目 |
物理性质的有关资料 |
|
颜色 |
黄绿色或琥珀色 |
|
性状 |
常温下为气体 |
|
气味 |
刺激性气味 |
|
沸点 |
-34.6℃ |
|
比重 |
1.47 (液体, 0℃,3.65atm) |
|
蒸气压 |
6.8atm (20℃), 10atm (30℃) |
|
蒸气密度 |
2.49 (空气=1, 20℃) |
|
水中溶解度 |
0.7%(重量百分率,20℃) |
2.健康危害资料表
| 项目 |
健康危害资料 |
| 容许浓度 |
0.5ppm, 1.5mg/m3 |
| 动物半致死剂量(LD50) |
|
| 动物半致死浓度(LC50) |
293ppm (1小时,大鼠、吸入) |
| 立即危害浓度(IDLH) |
10ppm |
| 致癌性分类 |
无 |
3.中毒的症状
氯可经呼吸道、皮肤或误食而使人中毒,其中毒是急性且高刺激性的,可在短期接触后造成永久性伤害甚至死亡。
(1)吸入性中毒的症状
吸入氯会刺激鼻、咽及上呼吸道,过量可能造成肺积水、工人吸烟又暴露于氯中会加强毒性作用。
|
吸入情况 |
中毒的症状 |
|
0.2ppm |
鼻轻微发痒。 |
|
1.0ppm |
咽喉干燥、咳嗽及轻度的呼吸困难、肺功能丧失。 |
|
5.0ppm |
中度呼吸困难,肺部易感染。 |
|
30ppm以上 |
严重的咳嗽、哽塞感及胸疼痛、呕吐。 |
|
1,000ppm以上 |
深呼吸数次会致死。 |
(2)皮肤接触性中毒的症状
高浓度下会严重刺激,造成灼热刺痛感、发红、起泡,直接接触其液体会造成严重的刺激、灼伤,甚至冻疮。
(3)食入性中毒的症状
食入氯液体可能造成疼痛、灼伤、口渴、痉挛及恶心,甚至造成死亡。
(4)眼睛接触性中毒的症状
眼睛接触氯会严重刺激,造成灼热、刺痛感、发红、流泪及起泡,直接接触其液体可能造成灼伤及永久损伤,甚且失明。
4.毒理学简介
人吸入LCL0:
500 ppm/5M。大鼠吸入LC50: 293 ppm/1H。小鼠吸入LC50:
137 ppm/1H。 氯气吸入后,主要作用于气管、支气管、细支气管和肺泡,导致相应的病变,部分氯气又可由呼吸道呼出。人体对氯的嗅阈为0.06mg/m3;
90mg/m3,可致剧咳; 120~180mg/m3,
30~60min可引起中毒性肺炎和肺水肿; 300mg/m3时,可造成致命损害;
3000mg/m3时,危及生命; 高达30000mg/m3时,一般滤过性防毒面具也无保护作用。
中毒机理:氯气吸入后与粘膜和呼吸道的水作用形成氯化氢和新生态氧。氯化氢可使上呼吸道粘膜炎性水肿、充血和坏死;
新生态氧对组织具有强烈的氧化作用,并可形成具细胞原浆毒作用的臭氧。氯浓度过高或接触时间较久,常可致深部呼吸道病变,使细支气管及肺泡受损,发生细支气管炎、肺炎及中毒性肺水肿。由于刺激作用使局部平滑肌痉挛而加剧通气障碍,加重缺氧状态;
高浓度氯吸入后,还可刺激迷走神经引起反射性的心跳停止。
扩展资料
氯气的化学性质
1.氯气是一种非常活泼的气体
学习氯气的化学性质时,总要配合一定数量的化学实验,同学们应充分利用作为知识第一来源(或直接来源)的化学实验,通过对实验的仔细观察去认识事物。你会注意到,氯气与许多类物质都能反应,如金属(钠、铁、铜等),非金属(氢气、磷等),化合物(水、碱等)。这说明氯气是一种非常活泼的气体。课本上指出,氯气与绝大多数金属都能发生反应。这种反应上的活性,比我们熟知的氧气还要高。
可以通过归纳整理,将氯气的化学性质的知识网络建立起来,如图:
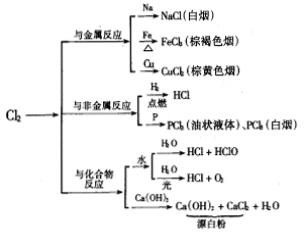
2.氯气的强氧化性
从对上述氯气参加的化学反应的分析看,大多数情况下,氯元素都是从单质(0价)变为具有负化合价的化合物,其本质过程可以用电子式表示:
![]()
由此可见,氯原子在反应中得到一个电子,而变为—1价的阴离子,这是氯气氧化性的本质,也是反应规律。
为什么说氯气具有强的氧化性呢?可以从这样几个方面去理解:①在发生氯原子夺电子的反应(即表现氯气氧化性)时,反应所需的条件不高,反应较易进行,说明此过程比较容易发生,从而说明氯气具有强的氧化性;②氯气参加的反应,一般进行的较为剧烈,放出的热量也比较大(通常伴有发光发热现象),这说明参加反应的物质内贮存的能量比较高(叫做内能),这也是理解氯气强氧化性原因的一个角度—即能量角度;③从具体反应入手,也可分析氯气的强氧化性。首先,氯气可以与活泼金属反应,例如钢,还能与不太活泼的金属铜反应。在与变价金属元素反应时,氯气总是将金属氧化为较高的价态:
![]()
![]()
![]()
在上述反应中,Fe总是被氧化为+3价,而不会有+2价的铁生成。
例1 自来水厂一般是用氯气对自然水进行消毒的。然而残留在水中的氯气会对人们的生产生活产生不良影响。不过,在消毒后的“降尘”处理中,会向留有残氯的水中加入一定量的硫酸亚铁,目的之一就是除去水中的残氯。试对其中的原理加以解释,写出有关的化学方程式。
解析:我们已经知道,单质铁与氯气反应可以被氧化为高价铁,而不是低价的亚铁。当溶解在水的氯气遇到硫酸亚铁中的亚铁离子时,将能很容易地将其氧化为+3价的
![]() ,同时,氯气本身被还原为—1价的
,同时,氯气本身被还原为—1价的 ![]() 。
。
答案:氯气是具有很强氧化性的,当用
![]() 处理含
处理含 ![]() 的水时,亚铁被氧化为高价铁。其化学方程式为:
的水时,亚铁被氧化为高价铁。其化学方程式为:
![]()
第二,氯气除可与金属顺利反应以外,还可以与其它非金属反应,生成非金属氯化物。一般来说,非金属是以夺电子为主的,但遇到氯气后却能被其氧化。因此,这更能说明氯气氧化性之强。例如红磷与氯气可顺利反应。如果红磷是干燥的,则放入氯气中不长时间,就会自动起反应。其反应产物木仅有低价的
![]() ,若氯气足量,则所有磷元素将全部被氧化为价态更高的
,若氯气足量,则所有磷元素将全部被氧化为价态更高的
![]() 。做为一个典型的实例,氯气甚至能够将同为强氧化剂的溴单质氧化而生成卤素的互化物氯化溴:BrCl。如果使碘与过量的氯气反应,则会使碘元素被氧化到更高的价态,形成
。做为一个典型的实例,氯气甚至能够将同为强氧化剂的溴单质氧化而生成卤素的互化物氯化溴:BrCl。如果使碘与过量的氯气反应,则会使碘元素被氧化到更高的价态,形成
![]() 等。
等。
氯气和水的反应较为特殊。氯气与水反应的产物为盐酸和次氯酸(
![]() ):
):
![]()
从化合价上分析,盐酸中氯元素的化合价为—1价,次氯酸中的氯元素的化合价为+l价。反应中,氢元素和氧元素都没有变价(分别仍为+1价和—2价),而对
![]() 中的氯元素而言,有50%降价,50%升价。我们把这种氧化还原反应叫做“自身氧化还原反应”,又叫做“歧化反应”。这个反应中生成的
中的氯元素而言,有50%降价,50%升价。我们把这种氧化还原反应叫做“自身氧化还原反应”,又叫做“歧化反应”。这个反应中生成的
![]() 是一种很弱的酸,它的酸性比同浓度的
是一种很弱的酸,它的酸性比同浓度的 ![]() 还要弱,因此,这个反应进行到一定程度后就达到了一种“平衡状态”(以后会学到),而不能使
还要弱,因此,这个反应进行到一定程度后就达到了一种“平衡状态”(以后会学到),而不能使
![]() 和
和 ![]() 完全反应,全部生成
完全反应,全部生成 ![]() 和
和 ![]() 。事实上,他和
。事实上,他和 ![]() 水中的
水中的 ![]() 的浓度是很低的。不过
的浓度是很低的。不过 ![]() 具有不稳定性,在光照的条件下发生分解反应:
具有不稳定性,在光照的条件下发生分解反应:
![]()
![]() 分解使其浓度下降,使
分解使其浓度下降,使 ![]() 与
与 ![]() 的反应得以继续进行,最终使
的反应得以继续进行,最终使 ![]() 全部反应掉。这两个过程可以用“方程式叠加”的方法理解:
全部反应掉。这两个过程可以用“方程式叠加”的方法理解:
![]() ①
①
![]()
![]()
![]() ②
②
①×2 + ②:
![]()
![]()
![]() ③
③
这个反应从形式上看与 ![]() 和
和 ![]() 的反应很类似,不过应把反应③当做一个“总反应式”去理解,它应分为①、②两步进行,而不是像
的反应很类似,不过应把反应③当做一个“总反应式”去理解,它应分为①、②两步进行,而不是像
![]() 与
与 ![]() 那样一步进行的,而且反应②比反应①要慢,并且需要光照的条件才行。
那样一步进行的,而且反应②比反应①要慢,并且需要光照的条件才行。
在分析了氯气与水的反应后,就不难理解碱与氯气的反应。
如果向氯水中加入 ![]() 溶液,就会发现氯水的颜色马上褪去。这可以理解为,氯水中的两种酸与
溶液,就会发现氯水的颜色马上褪去。这可以理解为,氯水中的两种酸与
![]() 迅速反应生成
迅速反应生成 ![]() 和
和 ![]() ,从而使氯气和水的反应迅速完成。也就是说氯气与
,从而使氯气和水的反应迅速完成。也就是说氯气与
![]() 反应可以理解为氯气与水的反应和中和反应的叠加。总反应为:
反应可以理解为氯气与水的反应和中和反应的叠加。总反应为:
![]()
不过这个反应进行得非常快,一般不把它理解为“分步反应”。
扩展资料
氯气和液氯
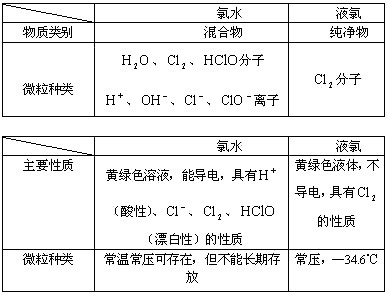
扩展资料
新型消毒剂“二氧化氯”
挪威的最近研究发现, 添加氯的自来水可能是畸型儿的凶手,
因为根据奥斯陆国家公共机构的研究, 自来水含氯量较高的省份, 长期统计发现生下畸形儿的比例比较高,
大约会高出 14%左右, 而神经管发育缺损 (如Spina bifida
) 的案件则高出 26%, 显示高氯地区的畸形儿可能与饮用水中的致癌突变物质有关。而ClO2作为强化氧化剂,它所氧化的产物中无氯化有机副产物;作为消毒剂,它具有广谱性的消毒效果,
无毒副作用,被称为第四代消毒剂,世界卫生组织已将其列为AI级安全灭菌剂。
 1983年美国国家环保局提出饮用水中三氯甲烷含量必须小于0.1mg/1。并推荐用ClO2消毒作为控制自来水中三氯甲烷的有效方法之一。
1983年美国国家环保局提出饮用水中三氯甲烷含量必须小于0.1mg/1。并推荐用ClO2消毒作为控制自来水中三氯甲烷的有效方法之一。
综合消毒剂的特点,可归纳如下:
1、不会生成有害物质,尤其对有机污染严惩的水体消毒时,杀菌效果更为突出,其氧化降解产物无毒害作用;
2、较自由氯杀菌能力强,一般为氯化消毒效果的2.5倍,因而,同等条件下的投量也氯化法用量少;
3、此消毒剂具有强氧化作用,可用于除臭、去色、氧化铁、锰等物质,且效果稳定;
4、ClO2制备工艺简单,投加方便,且成本较臭氧成本低,从总体水处理工艺上看,ClO2可作为沉淀水、澄清水或过滤水的氧化消毒剂,因而它很有可能取代氧消毒剂;
5、鉴于二氧化氯的各种优点,美国EPA也大力推荐它是一种强有力的潜在替代氯消毒的氧化型消毒剂。对水中残存有机物的氧化,ClO2比Cl2要优越,ClO2以氧化反应为主,而Cl2以亲电取代为主。经氧化的有机物多降解为含氧基团(羧酸)为主的产物,无氯代产物再现。此外,灰黄霉素、腐植酸也可被氧化降解,而且降解产物不以氯仿出现。这一点,是传统的氯处理方法决不能实现的。作为杀灭剂的有效性和稳定性:在ClO2、Cl2、O3和氯胺四种消毒剂中,综合考虑,则可认为ClO2的消毒效果最好。可用于处理自来水、食品厂、饮料厂、纯净厂、啤酒厂、肉食厂,游泳池、宾馆、饭店、招待所、会议室、影剧院、候车室、各种畜禽、水产养殖,用途十分广泛。