 设为首页
设为首页
 加入收藏
加入收藏
教学设计方案(一)
《酸的通性》实验引导探索教案设计
一、“实验引导探索法”的实质
美国心理学家布鲁纳指出:“发现不限于人类未知的事物,确切地说,包括用自己头脑亲自获得知识的一切方法。”“一个人要想使现有的知识成为自己的知识,必须亲自从事发现的行动。”因此扬弃“教师讲学生听”的传统教学方法,把教师的主导作用转到启发诱导上来,指导学生借助于教材、亲自去探索,主动去发现是现代教学方法,也是“实验引导探索法的灵魂和精粹。唯其这样,才能真正发挥学生的主体作用,让学生动手做、动眼看、动脑想、动口说,充分调动各种感官参与学习,课堂教学才会变得生动活泼、富有魅力,这样无疑比被动地接受知识要好得多。
二、“实验引导探索法”的教学结构
指导阅读→探索性实验→讨论归纳→巩固开拓这四个程序的目的和作用。
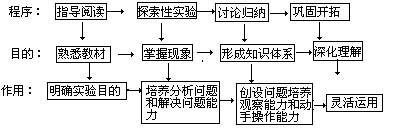
下面以初中化学第五章第四节《酸的通性》的教学为例加以说明:
考虑到学生已有盐酸、硫酸性质的知识基础,我们调整了知识结构,将书中实验六《酸的性质》中的验证性实验全部改成探索性实验,安排在《酸的通性》的课堂教学上进行,具体做法程序是:
(一)指导阅读
要求学生预习课本第八章第三节及课本第212—213页实验内容,把课文内容分解为若干知识点,再把知识点设计成简单的问题。
布置阅读提纲及预习题:1.紫色石蕊、无色酚酞、遇盐酸、硫酸有何变化?2.盐酸、硫酸分别都能跟哪些物质起反应?3.是否所有金属都能跟盐酸、硫酸发生置换反应、放出氢气? 4.含CO32-的盐(叫碳酸盐)跟盐酸、硫酸或硝酸反应的现象如何?5.完成下列反应方程式,思考起反应的物质分别属什么类别:①Fe+HCl——;②Cu(OH)2+H2SO4——;③Fe2O3+HCl——;④BaCl2+H2SO4 ——
(二)探索性实验
问题,即需要解决的矛盾。众所周知,它是知识的源泉,求知的动因,怎样才能激发学生积极探索,主动解决问题呢?我们认为让学生自己发现问题,可以调动他们的积极性。
具体实验内容是:
1.酸对指示剂作用:①稀HCl、H2SO4、HNO3分别对石蕊、酚酞试液的作用;②NaOH对石蕊酚酞试液的作用。
2.酸溶液跟活泼金属的反应:①镁和稀硫酸反应;②铁和稀硫酸反应;③铜和稀硫酸反应。
3.酸跟某些金属氧化物反应:①稀盐酸和带锈铁钉反应;②稀硫酸和少量氧化铜反应;③沙子(主要成份SiO2)中滴加盐酸。
4.酸跟某些盐的反应:①稀盐酸和硝酸银反应,再滴入稀HNO3;②稀硫酸和氯化钡反应,再滴入稀HNO3;③稀盐酸的碳酸钠反应;④硫酸钡沉淀中滴加稀盐酸。
5.酸跟碱反应:①盐酸和氢氯化钠反应;②稀盐酸和少量氢氧化钙粉末反应。
(三)讨论归纳
在学生探索性实验的基础上,组织有效的讨论,通过实验事实,诱发学生思考,运用学过的知识推理,把个别的知识与物质性质一一相联系,得出结论,让学生归纳出物质的性质,形成知识线,织成知识网。
1.学生做完第一组实验后,根据实验现象,可在教师的引导下,自己总结出指示剂遇酸,碱后的变色情况。
2.做完第二组实验后,老师可向学生提问:①是否所有金属都能跟酸发生反应?②起反应的金属反应的剧烈程度是否一样?学生汇报实验结果后,老师再指出,金属在水溶液中的活动性是有强弱之分的,通过三种金属分别放入盐酸溶液中的实验现象,分析得出三种金属的活泼性顺序。并告诉学生按金属活动性强弱顺序,可排成一个表,这样就自然地引出“金属活动性顺序表”。最后,启发学生结合实验结果进行分析,自己总结出哪些金属可用于制取氢气,哪些不能。
3.做第三组实验后,只要老师引导学生分析铁锈(主要成份Fe2SO3)和氧化铜是金属氧化物,而 SiO2(沙子)是非金属氧化物,学生就可以从对比中知道,酸与金属氧化物能起反应,而与非金属氧化物一般不起反应。(不包括酸与非金属氧化物发生的氧化——还原反应)从而得出酸能跟某些金属氧化物起反应的规律。
4.做完第四组实验后,老师与学生可共同归纳出:①碳酸盐与盐酸、硝酸反应有CO2气体放出。②从补充实验稀盐酸与硫酸钡不反应的对比实验中知道,盐酸与盐的反应只是指部分盐、至于哪些能反应,留待以后据复分解反应发生的条件来判断,为以后的学习留下伏笔。
5.酸跟碱的中和反应,我们补充做了将盐酸逐渐滴加到氢氧化钠的酚酞溶液中的实验,还可和同学们一起回忆盐酸、硫酸与 Cu(OH)2的反应,通过这些实验使学生了解怎样通过实验现象、观察出可溶性碱及不溶性碱是否与盐酸反应了的操作方法,再由教师演示实验[5—21],并介绍操作要领,得出中和反应概念。
最后,顺理成章地归纳出酸的五点通性、并让学生填写:1.酸溶液能使紫色试液变____,酚酞试液遇酸____。2.酸+金属(活泼)→____+____。3.酸+金属氧化物→____+____。4.酸+盐→____+____。5.酸+碱→____+____。
通过变验证性实验为探索性实验,变书本序讲为探索序讲课,使学生自己得出书本上所述的知识,避免了老师讲,学生听的被动局面,使学生掌握知识的过程变为积极主动的过程。同时,还能从中学习科学探索新知识的方法。
(四)巩固开拓
根据教学目标精心选编一些有代表性和启发性问题和练习,让学生将所学知识运用于新情境中、迁移重组以至创新,深化理解,提高能力。
1.如何鉴别NaOH、HCl、NaCl三种物质?
2.NaOH、HCl、H2O能否用酚酞指示剂鉴别?
3.把足量的盐酸加入盛有少量镁粉、铜粉、铁粉的混合物的烧杯里,完全反应后,加水稀释过滤,在滤纸上剩下什么物质?滤液里有什么物质?
4.有X、Y、Z三种金属分别投入等量的稀盐酸中,X不溶解、Y、Z都溶解并放出氢气,但Z与盐酸反应比Y剧烈,这三种金属活动性由强到弱的顺序应是()
A. X>Y>Z B. Y>Z>X C. X>Z>Y D. Z>Y>X
5.完成下列化学反应方程式,并指出哪个是中和反应?
①CaO+HNO3→ ②Fe+H2SO4(稀)→ ③Ba(OH)2+HCl→ ④CaCO3+HCl
三、“实验引导探索法”的实践体会
通过尝试,我们认为运用“实验引导探索法”进行教学,让学生充分发挥各种感官作用,采用讨论形式,老师启发引导学生来实现知识的传授,有以下一些优点。
1.有利于调动学生学习的主动性和自觉性,课堂教学显得生动活泼,从心理学角度看,学生始终处于学习的最佳心理状态,使课堂教学收到较高的效益。
2.有利于培养学生能力。实验中,亲自去发现问题,使动手能力和观察能力得到培养;讨论中,发表自己的见解,培养了表达能力;归纳整理,促成学生自学能力、分析综合能力等都得到有效锻炼与提高。
3.有利于发展学生思维。通过引导、推理、对比、分析、归纳训练了学生沿着正确的途径进行思维,初步掌握方法去分析,整理所学的代表物的个性与共性,强化了在理解基础上的记忆。由于物质性质繁琐难记而产生的学习畏难情绪得到改变。
总之,从教学结构上破除了“填鸭式”、“满堂灌”的教学方式,变“填鸭式”为“启发式”;变“教师为中心”为“学生为主体、教师为主导”;变“单纯传授知识”为发展智力、培养能力”;变教室从“教师的讲堂”为“学生的学堂”。
教学设计方案(三)
第一课时
重点难点: 酸的通性;常见金属的化学活动性顺序的识记和应用。
教学方法:复习、归纳和实验相结合。
教学用具、仪器:试管、滴管、镊子、培养皿、投影仪。
药品:稀盐酸、稀硫酸、氢氧化钠溶液、酚酞试液、石蕊试液、镁条、锌粒、铜片。
教学过程:
[提出问题,引入新课] 上节课我们学习了盐酸和稀硫酸,那么,盐酸和稀硫酸有哪些相似的化学性质?为何有这样相似的性质?并写出盐酸、硫酸和硝酸的电离方程式,从中发现了什么?
思考、讨论,书写电离方程式并回答问题:
HCl=H++Cl-
H2SO4=2H++SO42-
HNO3=H++NO3-
[讲述] 酸类在水溶液中都能电离出相同的阳离子—H+,所以它们具有一些共同的化学性质,即酸的通性。
[板书] 第三节 酸的通性PH值
酸的通性
1.酸溶液跟酸碱指示剂的作用
归纳总结酸与指示剂的作用并记忆。
2.酸与活泼金属反应生成盐和氢气。
[演示实验] 将培养皿放在投影仪上,倒入1:2稀盐酸,用塑料板条将其隔成四等份,分别放在镁条、锌粒、铁钉和铜片四种金属(实验前在投影仪玻璃上写好Mg、Zn、Fe、Cu)字样,再用漏斗分别罩住镁条和锌粒,用火柴燃生成的气体。
观察实验现象,比较四种金属与盐酸反应的速率,分析思考找规律,并写出有关化学方程式。
Mg+2HCl=MgCl2+H2↑
Zn+2HCl=ZnCl2+H2↑
Fe+2HCl=FeCl2+H2↑
Cu与HCl不反应.
[设问] 根据实验事实思考:什么样的金属与何种酸反应才能放出氢气呢?
通过探索实验使学生认识金属活动性的强弱及其活动性顺序。
金属活动性顺序:K 、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au
金属:活动性顺序中“H”前的金属
酸:盐酸或稀硫酸
[板书] 金属与酸 反应规律: 金属+酸→盐+氢气 (HNO3和浓H2SO4除外)
3.酸跟碱性氧化物反应生成盐和水
提问:什么叫碱性氧化物?
明确:凡能跟酸起反应生成盐和水的氧化物,叫做碱性氧化物。如:CuO、Fe2O3、MgO等
指出:金属氧化物大多是碱性氧化物。
金属氧化物中,Na2O、K2O、CaO溶于水,并与水发生反应生成可溶性碱。
如:Na2O+H2O==2NaOH
CuO、MgO等不溶于水,也不于水发生反应。
4.酸和碱起中和反应生成盐和水。
[设问]盐酸与氢氧化钠反应,怎样证明两者恰好反应?
思考讨论,回答。用指示剂变色来证明。
做实验8-20,逐滴一振荡一刚变无色为止
记录实验现象,指出反应物、生成物及其类别,总结出酸和碱反应生成盐和水的规律。
提问:什么叫中和反应?中和反应属于哪种基本反应类型?
明确:酸和碱作用生成盐和水的反应叫中和反应。中和反应是复分解反应的一种。
反应规律:酸+碱→盐+水
[提出问题]试举出中和反应在生产和生活中应用的例子。
5.酸跟盐反应生成另一种酸和另一种盐.
回忆:已学过的酸、盐之间反应的化学方程式 。
HCl+AgNO3=AgCl↓+HNO3
H2SO4+BaCl2=BaSO4↓+2HCl
[学生小结] 我们学习了酸的通性,通性是一般规律,可以指导我们学习,但规律有一定适用范围,所以也要注意个别现象。
试进行小结,体会本节内容。
对学生进行由个别到一般的认识事物方法的教育,学会用“规律”指导学习的科学方法。
第二课时
重点难点:溶液的PH值及其应用。
教学方法:实验、阅读、讲解、归纳相结合。
教学用品、仪器:试管、表面皿、玻璃棒、投影仪。
药品:PH试纸、稀盐酸、氢氧化钠溶液。
其它: 土壤样品。
教学过程:
[练习]写出HCl、H2SO4、HNO3的电离方程式。
指导学生正确书写化学用语。
写出电离方程式:
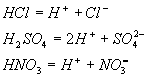
[设问] 上节课我们总结了酸的五点通性,酸为什么具有相似的化学性质?
思考并回答:电离时产生的阳离子全部是氢离子。
[提问]酸有哪些通性?
在学生回答的基础上小结。
[过渡语] 我们学习了酸的如何命名?如何给酸进一步分类呢?
[板书]
1.酸的分类和命名
指导学生阅读课文P.162
通过读书,总结出酸的分类和命名。
[板书]
(1)分类:
根据酸分子中是否含氧分为 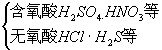
根据酸分子中电离出氢离子个数分为 
命名:
含氧酸:“某酸”如H2SO4硫酸
无氧酸:“氢某酸”如H2S氢硫酸
[过渡语] 在生活中,人们往往不但需要知道某溶液的酸碱性,还需要知识溶液酸碱性的相对强弱,溶液酸碱性的强弱如何表示?
[板书]
2.PH—酸碱度的表示方法
[指导阅读]
指导学生阅读教材P.163
阅读教材并自己总结出PH值的范围及溶液PH值的三种情况
[板书]PH范围通常在0~14之间
PH=7 溶液呈中性
PH>7 溶液呈碱性
PH <7 溶液呈酸性
[引入问题] 溶液的PH值用什么方法测定?用PH试纸。
展示PH试纸
[指导学生实验] 做课本P.163 实验(8-21)和(实验8-22)
分组实验
[指导学生阅读课文]阅读课文P.164及表8-1和表8-2.
[指导学生小结] 本节课学习了酸的分类和命名,重点学习了PH——溶液酸碱度的表示方法,这不仅从理论上知道了溶液酸碱度对生活、生产及科研的重要意义,还将对今后的实际应用起指导作用。