 设为首页
设为首页
 加入收藏
加入收藏
教学设计方案一
第一节 氯气
第一课时
教学目标:
知识目标:
1.使学生了解氯气的物理性质。
2.掌握氯气的化学性质,以氯原子的结构特点作为切入点,通过氯气与多种物质的反应来认识氯气是一种化学性质很活泼的非金属单质,具有强氧化性。
3.进一步了解广义燃烧的概念
能力目标:
通过观察实验现象、分析实验结果培养学生的观察能力、分析能力。培养学生通过实验研究物质性质的科学方法。
情感目标:
激发学生透过现象探究本质的探索兴趣。尊重科学,以发展的眼光看待科学。
教学重点:氯气的化学性质
教学难点:氯气的化学性质
教学方法:实验-分析-得出结论
教学过程:
引入:前面学习了碱金属元素的有关知识,大致了解了化学上学习、认识元素的方法。碱金属是几种在原子结构和元素性质上都有一定相似性的金属元素。这一章我们要学习在原子结构和元素性质上都有一定相似性的非金属元素。它包括氟、氯、溴、碘、砹五种元素。我们重点学习它的代表――氯元素。
板书:第四章 卤族元素
氟F 、氯Cl 、溴Br 、碘I 、砹At
简介:舍勒发现氯气。后来戴维确认氯气是单质,将这种元素命名为Chlorine,希腊文意为“绿色的”。
展示:认识氯气的庐山真面目。用白纸做衬板,让学生观察颜色。
讲解:氯气的毒性。强调闻气体气味时应该注意方法,只要方法正确,是没有危险的。教师演示,可以让学生尝试。
实验:向盛有氯气的试管中注入一定量的水,与盛有蒸馏水的试管对比。
小结:氯气的主要物理性质。
板书:第一节 氯气
一、氯气的性质和用途
1.物理性质:黄绿色有刺激性气味的气体,常温下能溶于水(1:2),比空气重,易液化,有毒。
提出:液氯和氯水是有区别的。
提问:氯原子的结构特点,让学生画出其原子结构示意图,根据结构推测氯气的化学性质是否活泼,它具有氧化性还是还原性?
追问:氯气可以和哪些物质反应表现出它的强氧化性?氯气的化学性质要从实验入手。
回顾:钠在氯气中燃烧的实验现象(有条件的也可以播放视频文件或者演示实验,实验时最好用玻璃匙,取一小片金属钠,直接伸入盛有氯气的集气瓶中,就可以看到现象。)
微机演示:氯化钠的形成过程
分析:让学生写出方程式,标出电子转移的方向和数目,找出此反应的氧化剂。
板书:2.氯气的化学性质
(1)与金属反应
2Na + Cl2 ![]() 2NaCl
氧化剂:Cl2
2NaCl
氧化剂:Cl2
引言:钠是活泼的金属,如果换成中等活泼的铁会如何呢?
视频:铁在氯气中燃烧(实验中注意与钠对比,铁丝需要在空气中加热,然后再伸入氯气的集气瓶中)
小结:现象:剧烈燃烧,集气瓶中充满棕褐色的烟。
让学生写出方程式,标出电子转移的方向和数目,找出此反应的氧化剂。说明铁被氧化到高价。
板书:2Fe + 3Cl2
![]() FeCl3
氧化剂Cl2
FeCl3
氧化剂Cl2
说明:通常条件下,干燥的氯气不和铁反应,因此可以用钢瓶储运液氯。
展示图片:储氯钢瓶。
引言:对于不活泼的金属铜呢?能反应吗?让实验来说明。
演示实验:铜在氯气中燃烧。
小结:实验现象,写出方程式,指出氧化剂。对比铁和铜在氯气中燃烧的现象,并注意和钠对比反应条件的不同。
讲述:棕色的烟是氯化铜的颗粒,注入水后,由于溶液的浓度不同,颜色也有差别。
板书:Cu + Cl2
![]() CuCl2
氧化剂Cl2
CuCl2
氧化剂Cl2
过渡:氯气除了可以和金属反应,还可以和非金属反应。
演示实验:氢气和氯气反应
(1)点燃条件下反应
(2)氢气和氯气在光照的条件下反应
(说明:有条件的话可以两个实验都演示。氯气和氢气混合光照爆炸的实验要求较高,成功率不是很高,可以播放视频文件)
小结:现象
板书:(2)与非金属反应
H2
+ Cl2 ![]() 2HCl
H2 + Cl2
2HCl
H2 + Cl2 ![]() 2HCl
2HCl
补充实验:红磷和氯气反应
板书:
2P
+ 3Cl2 ![]() 2PCl3
PCl3 + Cl2
= PCl5
氧化剂Cl2
2PCl3
PCl3 + Cl2
= PCl5
氧化剂Cl2
讨论:燃烧是否需要氧气参加?比较钠、铜等在氧气中燃烧,钠、铁、铜等在氯气中燃烧,找出共同的特点,给燃烧重新下一个定义。
小结:氯气与金属、非金属反应表现出强氧化性。
作业:书后作业。

![]()
教学设计方案二
第一节 氯气
第二课时
教学目标:
知识目标:
1.通过氯气的化学性质来认识其用途。
2.掌握氯气的实验室制法的基本原理和方法。
3.掌握氯离子的检验方法。
能力目标:
通过观察实验现象、分析实验结果培养学生的观察能力、分析能力。培养学生通过实验研究物质性质的科学方法。
情感目标:
激发学生透过现象探究本质的探索兴趣。
教学重点:氯气的化学性质,氯离子的检验
教学难点:氯气的化学性质,氯离子的检验
教学方法:实验-分析-得出结论
教学过程:
引入:上一节我们学习了氯气可以和金属、非金属单质反应。今天继续学习氯气和化合物的反应。氯气可以溶于水(1:2),能和水反应吗?
演示实验:把氯水滴加到紫色石蕊试液中,让学生观察现象。
讨论:如何解释先变红,后褪色的现象。
解释:说明氯水显酸性。氯水有漂白性。
提问:氯水的颜色是黄绿色,说明有氯分子存在。那么是Cl2有漂白性吗?
演示实验:次氯酸的漂白作用(也可以播放动画)
讨论:实验现象说明什么?
结论:说明Cl2与水反应生成了一种具有漂白性的物质。
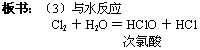
动画演示:次氯酸分解
讨论:新制的氯水和久置的氯水有什么不同?
讲述:次氯酸因为有强氧化性,因此可以使很多有色物质褪色。以前初中还学过一种物质可以使有色物质脱色,是活性炭,它漂白的机理是因为它具有疏松多孔的结构,可以吸附有色物质,因此它的脱色是物理变化。而次氯酸的漂白是化学变化。次氯酸虽好但不稳定。如何利用它的漂白性为人类服务,又能解决稳定存放的问题?把酸转化成盐。与碱反应可以完成转化。
板书:(4)与碱反应
2Ca(OH)2+ 2Cl2 = Ca(ClO)2 + CaCl2 + 2H2O
次氯酸钙
Ca(ClO)2 + CO2 + H2O= CaCO3↓+2HClO
解释:次氯酸钙比次氯酸稳定,容易储运。市售的漂白粉和漂白精的有效成分就是次氯酸钙。漂白原理是次氯酸钙与空气中的二氧化碳和水蒸气反应生成次氯酸,这个反应也说明碳酸的酸性比次氯酸还强。因此注意密闭保存。
提问:Cl2和氢氧化钠溶液反应的化学方程式如何书写。
板书:2NaOH+ Cl2 = NaClO + NaCl + H2O
分析:氯元素价态的变化,指出这是自身氧化还原反应,又叫歧化反应。Cl2既是氧化剂又是还原剂。
讲述:性质决定用途。小结氯气的用途。
板书:3.用途
演示氯气的实验室制法的课件
讨论反应原理、装置。然后教师演示(或者播放视频)最后讨论实验的有关问题。
板书:二、氯气的实验室制法
MnO2 +
4HCl(浓) ![]() MnCl2 + 2H2O+
Cl2↑
MnCl2 + 2H2O+
Cl2↑
讲述:氯气能与很多金属反应生成盐,其中大多数盐能溶解于水并电离出氯离子。
演示实验:氯离子的检验
提出要求:观察现象,写出相应的离子方程式。
板书:三、氯离子的检验
Ag+ + Cl-=AgCl↓
CO32- +2Ag+ =Ag2CO3 ↓
Ag2CO3 + 2H+=2Ag+ + CO2 ↑ + H2O
小结:氯离子的检验方法
总结:氯气有很强的氧化性。至于其他卤素有什么样的性质在下一节将继续学习。
作业:书后作业;对比氢气、氧气、氯气的实验室制法,列表表示。
