设为首页
设为首页
 加入收藏
加入收藏
教学设计方案一
课题:乙酸 羧酸
教学重点:乙酸的化学性质,如弱酸性、酯化反应,酯的水解等。
教学难点:酯化反应的概念、特点及本质。
教学方法:实验及多媒体辅助教学。
教学手段:通过实验引导学生探究结构(官能团)与性质的关系。并对比醇(羟基)来学习乙酸的化学性质。
教学思路:仍采用“性质→结构”、“官能团决定化合物特性”的模式。从实验入手,来突出重点,用多媒体使学生易于理解,从而突破难点。
教学过程:
第一课时
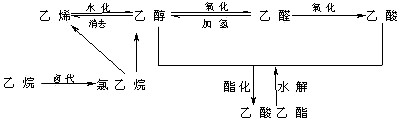
[复习]请同学们根据信息写出各步转化的方程式(注R—部分相同)。
![]()
[引题]在上述反应中,醇氧化生成醛,醛再被氧化生成羧酸,那么什么是羧酸?
[解答]分子烃基(或氢)和羧基相连而构成的有机化合物称为羧酸。本节将重点学习羧酸的代表物——乙酸。
[板书] 乙酸
一、乙酸的结构
[讲解]乙酸又名醋酸,它是食醋的成分之一,是日常生活中经常接触的一种有机酸。
[微机展示]乙酸分子的比例模型。
[提问]请同学们归纳出乙酸分子的分子式、结构简式。
[回答]分子式为C2H4O2,结构简式为:CH3COOH
[学生练习]试写出乙酸的结构式。
[板书]
分子式:C2H4O2;结构简式:CH3COOH
其结构简式: ![]() 其官能团:—COOH(羧基)
其官能团:—COOH(羧基)
[展示]冰醋酸及食用醋的样品,让学生观察颜色状态,并闻气味。
[板书]
二、乙酸的物理性质
乙酸又叫醋酸,无色冰状晶体(冰醋酸),溶点16.6℃,沸点117.9℃。有刺激性气味。易溶于水。
[过渡]在日常生活中,我们常用少量的食醋除去在水壶里的水垢(CaCO3等杂质),请同学们试说出,这应用了哪一个化学原理。
[学生回答]醋酸和水垢(CaCO3)反应生成二氧化碳,运用了强酸(醋酸)制弱酸(H2CO3)这一原理。
[解答]这说明醋酸具有酸性,我们观察乙酸分子结构,可以发现在乙酸分子中存在羟基,由羟基电离出H+。
[提问]请同学们试说出几种可以检验醋酸具有酸性的方法。
[回答]用指示剂;用金属活动性顺序表中氢前的金属置换H+为H2性质。
[演示实验6—1 7 ]可由学生演示。
[讨论回答]溶液有气泡产生。说明乙酸溶液呈酸性,与碳酸钠反应生成二氧化碳气体。
[板书]
三、化学性质
(一)酸性
1.与Na2CO3溶液反应。
2CH3COOH + Na2CO3
= 2CH3COONa + CO2↑+H2O
[学生分组实验] 向一支试管中滴加约3mL乙酸溶液,将表面用砂纸打磨过的镁条插入乙酸溶液。观察现象。
[回答]溶液中有气泡产生。
[板书]
2.与Mg反应
Mg + 2CH3COOH → (CH3COO)2Mg
+ H2↑
[提问]讲解乙酸是一种弱酸,请同学们试说出,如何证明乙酸是一种弱酸。
[回答]选择CH3COONa,滴加酚酞试液,试液变红,说明醋酸钠水解呈碱性。
[讲解]“弱”指“醋酸”的酸性弱。但用醋酸可以除去水垢,说明其酸性比碳酸的酸性强。碳酸的酸性比苯酚的酸性强。即醋酸的酸性比碳酸的酸性强,碳酸的酸性比苯酚的酸性强。
[板书]
3.酸性比较:CH3COOH > H2CO3
> C6H5OH
电离方程式:CH3COOH ![]() CH3COO—
+ H+
CH3COO—
+ H+
[探讨] 在学习乙醇的性质中,我们学习了乙醇和浓硫酸在140℃时发生分子间脱水,一个乙醇分子脱羟基,另一个乙醇分子脱羟基上氢原子,生成乙醚。在乙酸中也存在羟基,如果将乙醇、乙酸和浓硫酸共热能否发生反应。
[演示实验6— 1 8 ]可由学生操作。
[板书]
(二)酯化反应
定义:醇和酸起作用,生成酯和水的反应叫做酯化反应。
[回答]在液面上可以看到有透明的油状液体产生,并可闻到水果香味。
[提问]根据酯化反应的定义,生成1个水分子需要一个氧原子及二个氢原子,根据以前我们所学的知识应该是一个羟基与一个氢原子生成一个水分子。请同学们试说出乙醇与乙酸发生酯化反应可能有几种可能?
[微机演示]动画素材中多媒体乙酸的酯化反应。
[讲解]在多媒体展示中,我们可以看到,在酯化反应中是羧酸分子里的羟基与醇分子里的氢原子结合成水分子,其余部分互相结合成酯。
[板书]
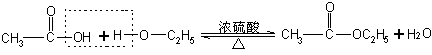
[板书]用PowerPoint展示
1.反应机理:醇脱氢原子,羧酸脱羟基结合生成水。
2.酯化反应可看作是取代反应,也可看作是分子间脱水的反应。
3.饱和碳酸钠溶液的作用:
(1)中和挥发出来的乙酸,生成醋酸钠(便于闻乙酸乙酯的气味)。
(2)溶解挥发出来的乙醇。
(3)抑制乙酸乙酯在水中的溶解度。
(4)硫酸的作用:催化剂;吸水性,该反应是可逆反应,加浓硫酸可促进反应向生成乙酸乙酯的反应方向进行。
我们认识乙酸的化学性质是由羧基决定的。具有羧基的有机酸,都跟乙酸有相似的化学性质,下一节课我们将着重研究羧酸。
[作业] 1.思考:为什么酒存放时间越久越香?
2.预习乙酸的用途。
板书设计:
乙酸 羧酸
一、乙酸的结构
分子式:C2H4O2
结构简式:CH3COOH
结构简式:
![]()
其官能团:—COOH(羧基)
二、乙酸的物理性质
乙酸又叫醋酸,无色冰状晶体(所以又称冰醋酸),溶点16.6℃,沸点117.9℃。有刺激性气味。易溶于水。
三、化学性质
(一)酸性
1.与Na2CO3溶液反应。
2CH3COOH + Na2CO3
= 2CH3COONa + CO2↑
+H2O
2.与Mg反应
Mg + 2CH3COOH → (CH3COO)2Mg
+ H2↑
3.酸性比较:CH3COOH > H2CO3
> C6H5OH
电离方程式:CH3COOH ![]() CH3COO—
+ H+
CH3COO—
+ H+
(二)酯化反应
定义:醇和酸起作用,生成酯和水的反应叫做酯化反应。
![]()
1.反应机理:醇脱氢原子,羧酸脱羟基结合生成水。
2.酯化反应可看作是取代反应,也可看作是分子间脱水的反应。
3.饱和碳酸钠溶液的作用:
(1)中和挥发出来的乙酸,生成醋酸钠(便于闻乙酸乙酯的气味)。
(2)溶解挥发出来的乙醇。
(3)抑制乙酸乙酯在水中的溶解度。
4.硫酸的作用:催化剂;吸水性,该反应是可逆反应,加浓硫酸可促进反应向生成乙酸乙酯的反应方向进行。
[讲解] 在科学上采用示踪原子法(H—18O—C2H5与乙酸反应)研究,发现18O存在于乙酸乙酯中,说明在酯化反应中,一般是醇脱氢,羧酸脱羟基。一般命名为某酸某酯,如乙酸与乙醇反应生成物为乙酸乙酯。
[总结]
1.乙酸的分子式为C2H4O2,结构简式为CH3OOH,它的官能团是羧基(—COOH)。
2.乙酸的化学性质:
⑴具有弱酸性:CH3COOH ![]() CH3COO—+H+,乙酸水溶液中有H2O、CH3COOH、H+、CH3COO—及OH—。
CH3COO—+H+,乙酸水溶液中有H2O、CH3COOH、H+、CH3COO—及OH—。
⑵乙酸与含醇羟基的有机物可发生酯化反应:

酯化反应机理:羧酸分子中羧基上的羟基与醇分子中的羟基上的氢原子结合而生成了水,余下部分结合生成酯。酯化反应中,浓硫酸所起的作用是催化吸水作用。
教学方案设计二
第二课时
[复习]请同学写出乙酸与乙醇发生酯化反应的化学方程式。
[讲解]请同学们阅读有关酯类的内容。
[引语]下面我们来学习酯类化合物的存在及用途
[板书]
四、酯类化合物
(一)低级酯存在于各种水果和花草中,具有芳香气味的液体。
[讲解]梨里含有乙酸异戊酯,苹果和香蕉含有异戊酸异戊酯。
[讲解]酯是有机物,它具有有机物的一般性的物理性质。
[板书]
(二)主要物理性质:密度一般小于水,并难溶于水,易溶于乙醇和乙醚等有机溶剂。
(三)用途:可用溶剂,也可用制备饮料和糖果的香料。
[讲解]下面我们来学习酯的化学性质——水解反应。
[板书]
(四)水解反应:
[实验6—3]
该实验分为三组,反应条件各不相同,以探索水解反应的条件,试填空下表:
|
乙酸乙酯用量 |
蒸馏水 用量 |
反应条件 |
实验现象 |
化学 方程式 |
|
| 1 |
6d |
5.5mL |
70℃~80℃ |
没有多大变化 |
|
| 2 |
6d |
5mL |
硫酸(1:5) 70℃~80℃ |
还有一点 乙酸乙酯气味 |
|
| 3 |
6d |
5mL |
NaOH(30%) 70℃~80℃ |
乙酸乙酯气味消失 |
[板书]
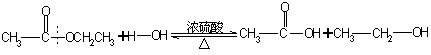
1.在酸中的反应方程式:
2.在碱中反应方程式:
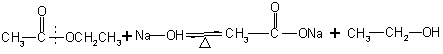
[学生讨论]
(1)实验说明了什么?
(2)试比较哪种条件下,乙酸乙酯水解更彻底?为什么?
(3)水解反应是酯化反应的逆反应,试分析水解反应的历程是怎样的?
(4)该实验中硫酸和氢氧化钠的作用是怎样的?
[提问]请同学们根据乙酸乙酯的分子式,试写出酯的通式?
[讲解]下面我们来学习羧酸的性质。请同学们阅读P176页,试解答以下几个问题:
1.请同学说出羧酸的定义及分类方法;
2.写出饱和一元羧酸的通式;
3.羧酸物理性质;
4.请同学比较下列物质酸性强弱:甲酸、乙酸、碳酸、苯酚;
5.什么叫做高级脂肪酸。
[板书]
五、羧酸
(一)羧酸是羧基跟烃基或氢直接相连构成的有机物。
(二)分类:
1.根据羧基相连的烃基不同分为:脂肪酸、芳香酸。
2.根据羧酸分子中羧基的数目,羧酸又可以分为:一元酸、二元酸(如乙二酸HOOC—COOH)、多元酸。
[思考]请同学们写出甲酸的分子式,并分析甲酸的性质。
[板书]
3.甲酸除具有酸的性质外,还有醛的性质。
[讲解]羧酸在自然界广泛存在,是重要的工业原料。
[巩固练习]
1.下列说法中正确的是( )
A、只有链烃基与羧基直接相连才叫羧酸。
B、饱和一元脂肪酸的组成符合通式CnH2nO2。
C、羧酸的酸性都比碳酸弱。
D、甲酸乙酯、乙酸甲酯、丙酸互为同分异构体。
答案:B
2.下列有机物中,既能发生消去反应,又能发生酯化反应,还能发生催化氧化的是(
)
A、CH3OH
B、BrCH2CH2COOH
C、CH3CH2CH2OH D、C6H5Cl
答案:B
[小结]下面是有机化合物衍生物之间一般关系:
[板书]小结:
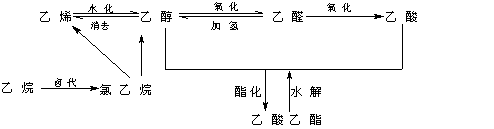
[作业]完成课后习题
板书设计:
四、酯类化合物
(一)低级酯存在于各种水果和花草中,具有芳香气味的液体。
(二)主要物理性质:密度一般小于水,并难溶于水,易溶于乙醇和乙醚等有机溶剂。
(三)用途:可用溶剂,也可用制备饮料和糖果的香料。
(四)水解反应:
1.在酸中的反应方程式:
![]()
![]()
![]()
2.在碱中反应方程式:
![]()
![]()
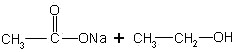
五、羧酸
(一)羧酸是羧基跟烃基直接相连的脂肪酸和芳香酸。
(二)分类:
1.根据羧基相连的烃基不同分为:脂肪酸、芳香酸。
2.根据羧酸分子中羧基的数目,羧酸又可以分为:一元酸、二元酸(如乙二酸HOOC—COOH)、多元酸。
(三)甲酸除具有酸的性质外,还有醛的性质。
小结:几种衍生物之间的关系