 设为首页
设为首页
 加入收藏
加入收藏
教学设计方案(一)
重点
(1)电离。
(2)书写常见的酸、碱、盐的电离方程式。
难点 教会学生根据宏观现象,进行微观本质的分析方法和逻辑推理能力。
课时安排 2课时。
教具准备
试验物质导电性的装置,干燥的氯化钠固体,硝酸钾固体,氢氧化钠固体,蔗糖固体,酒精,蒸馏水,氯化钠溶液,硝酸钾溶液,氢氧化钠溶液,磷酸溶液,酒精溶液,蔗糖溶液,盐酸,硝酸溶液,硫酸溶液,氢氧化钾溶液,氢氧化钡溶液,碳酸钠溶液,硫酸镁溶液,氯化钡溶液。
教学过程
前面我们学习了溶液的有关知识,这节课,我们来看一看溶液是否能导电。下面我们来观察一下实验现象。
1.溶液的导电性
演示[实验8-1]试验下列物质的导电性实验:氯化钠固体、硝酸钾固体、氢氧化钠固体、蔗糖固体、酒精、蒸馏水。
[学生观察思考] (1)电灯泡是否亮?(2)根据已有的物理知识回答,电流是怎么形成的?(3)氯化钠是哪种类型的化合物?它的组成微粒是什么?
[演示实验]再把蒸馏水分别倒入氯化钠固体,硝酸钾固体,氢氧化钠固体,蔗糖固体,酒精等中配成溶液。
[学生观察思考]
①电灯泡是否亮?
②上述物质变成溶液后,为什么有的物质能够导电?有的物质仍不能够导电呢?
(先小组讨论,后点拨释疑。)
[结论]
电离:物质溶解于水后,离解成自由移动的离子的过程。
通过上面的学习,请同学们分析讨论:
物质必须同时具备哪两个条件,才能导电?(目的:能力发展,思维延伸)
[推论]必须有自由移动的带电的微粒的物质才能导电。
电离常用电离方程式表示。
2.电离方程式
![]()
![]()
![]()
![]()
请同学们分析讨论:
(1)离子所带电荷数和电性,与电离前它在化合物中的元素或原子团的化合价数值及正负性有何关系?
(2)在电离过程中,原子团拆不拆开?
(3)电离出的阳离子所带正电荷总数与阴离子所带负电荷总数有什么关系?
(先小组讨论,后点拨释疑,得出书写电离方程式的注意事项及下面结论)
在能导电的溶液里,所有阳离子带的正电荷总数和所有阴离子带的负电荷总数是相等的。所以,整个溶液不显电性。
3.酸碱盐的电离
[教师活动]演示[实验8-2],试验盐酸、硝酸和硫酸的导电性。
[学生活动]观察电灯泡是否亮?
[教师活动]提问由所观察到的实验现象,你能得出哪些结论?
[目的意图]使学生产生思维,复习联想上一节所学过的溶液能否导电的本质。
[学生活动]同座位同学互相讨论,最后得出以下几点结论:
灯泡都亮,说明这几种溶液中都有存在能自由移动的离子,通过书写电离方程式,知道这些溶液都存在有哪些离子。
![]()
![]()
![]()
通过书写电离方程式,找出这几种化合物电离出的离子的共性,由此得出酸的概念。
(1)酸 ![]()
定义:电离时生成的阳离子全部是氢离子的化合物叫做酸。
通过同样的教学方法分别得出碱和盐的概念。
(2)碱 ![]()
![]()
![]()
![]()
定义:电离时生成的阴离子全部是氢氧根离子的化合物。
(3)盐
![]()
![]()
![]()
![]()
定义:电离时生成金属离子和酸根离子的化合物叫做盐。
[教师活动]提问
通过对酸、碱、盐电离出离子的特点,你判断一下 ![]() 应该属于哪一类化合物?
应该属于哪一类化合物?
[目的意图]检验学生对酸、碱中“全部”两字的理解程度。
总结、扩展

溶液的导电性可用下式表示:

教学设计方案(二)
重点难点 电离、电离方程式的书写。
教学方法 实验、讨论、启发引导法。
教学用品
仪器:低压直流电源、小灯泡、导线、盛待测物的容器、石墨电极。
药品:食盐固体、硝酸钾固体、氢氧化钠固体、蔗糖固体、蒸馏水、酒精、氯化钠溶液、硝酸钾溶液、氢氧化钠溶液、磷酸溶液、酒精溶液、蔗糖溶液。
教学过程
第一课时
[引言]在前几章中我们学过了氧、氢、碳、铁等单质以及它们的化合物,请同学们回忆我们学过的化合物都有哪些?写出这些化合物的化学式。
[板书](分类板书)
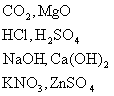
[过渡]无机物种类很多,根据化合物组成和性质可分为若干类,我们来分类研究它们。
[演示实验]溶液的导电性
课本P149(实验8-1)
[问题讨论]启发引导分析讨论
1.金属导电的原因。
2.食盐晶体中存在的微粒和其溶液中存在的微粒有何不同?分析溶液导电的原因。
3.蔗糖晶体、酒精不导电,其水溶液也不导电的原因。
在学生讨论基础上引导学生认识电离概念。
[板书]第一节 酸、碱、盐溶液的导电性
溶液的导电性
电离
金属能够导电,是由于金属中存在着自由移动的、带负电的电子。
食盐晶体中离子不能自由移动,所以不导电;而食盐溶于水产生出自由移动的 ![]() 和
和 ![]() ,所以能导电。
,所以能导电。
蔗糖、酒精是分子构成的物质,其纯净物或水溶液均不存在离子,所以均不导电。
[问题讨论]离子符号和元素(原子团)化合价表示方法有何不同?
[分析讨论]我们用什么式子来表示物质发生电离呢?
引导学生书写电离方程式,边写边指导学生总结,电离方程式书写注意事项。
[板书]2、电离方程式
[问题讨论三]物质在溶液中发生电离后为什么整个溶液不显电性?
第二课时
[复习提问]什么是电离?为什么氯化钠晶体不导电,而氯化钠水溶液却导电?
引起回忆,检查学生对电离概念的理解情况。
[演示实验]酸溶液的导电性,课本P151(实验8-2)
观察、记录,用离子观点解释,写出有关的电离方程式:
HCl = H+ +Cl— H2SO4 = 2H+ + SO42— HNO3 = H+ + NO3—
[分析讨论]通过演示实验和电离方程式总结出什么是酸?
归纳得出酸的定义和组成特点:电离时生成的阳离子全部是氢离子的化合物叫做酸。
[板书]
二、酸、碱、盐的电离
1、酸
电离时生成的阳离子全部是氢离子的化合物叫做酸。
强调酸定义中的“全部”二字重要性。
[演示实验]碱溶液导电性,课本P152(实验8-3)
观察、记录、用离子观点解释,并写出有关的电离方程式:
NaOH = Na+ + OH— KOH = K+ + OH—
对学生进行透过现象看本质的辩证唯物主义思想教育,培养学生微观想象能力。
[分析讨论]通过演示实验和电离方程式,总结出什么是碱?
[板书]
2、碱
电离时生成的阴离子全部是氢氧根离子的化合物叫做碱。
强调碱定义的“全部”二字重要性。
[演示实验]盐溶液导电性,课本P152(实验8-4)
观察、记录,并用离子观点解释,写出有关的电离方程式:
NaCl = Na+ + Cl— KNO3 = K+ + NO3—
[分析讨论]什么是盐?盐在组成上有何特点?
分析讨论、总结出盐的定义和盐在组成上的特点。
[板书]
3、盐
电离时生成金属离子和酸根离子的化合物叫做盐。
教学设计方案(三)
教学重点
1.电解质的电离。
2.书写常见的几种电解质的电离方程式。
教具
直流电源、烧杯、药匙、坩埚、泥三角、铁三脚架、电极、导电灯座、酒精灯、火柴、导线。
干燥的食盐晶体、硝酸钾晶体、氢氧化钠晶体、无水硫酸、蔗糖晶体、无水酒精、蒸馏水、食盐溶液、硝酸钾溶液、氢氧化钠溶液、硫酸溶液、蔗糖溶液、酒精溶液。
教学过程
[复习提问] (二个学生板演,其余学生练习)
根据组成对下列各物质进行分类并写出化学式。
硝酸钾 氢氧化钠 水银 蒸馏水 铝 酒精 氦气 硫酸 氯化钠 石墨 蔗糖
[板书]
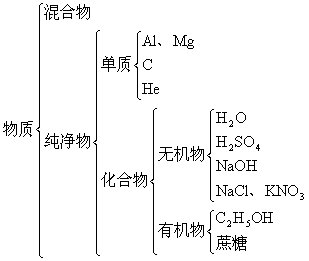
[小结] 根据复习提问,由物质的分类引入本章教材。从金属能导电联系到化合物能否导电?什么样的化合物能导电?引入本节教材。
[板书] 一、溶液的导电性
[演示]实验 物质的导电性;实验 物质熔化时的导电性
组织学生观察现象,认真思考;同时填写“物质导电性表”(事先用小黑板写好)中的空白:
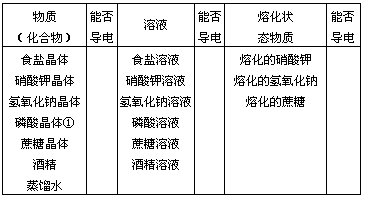
①磷酸晶体,可用柠檬酸等代替。
[总结] 上列化合物在水溶液里或熔化状态下能否导电来分类可分为:
1.在水溶液里或熔化状态下能导电的化合物叫做电解质,如食盐、氢氧化钠等。
2.在水溶液里和熔化状态下不能导电的化合物叫做非电解质,如蔗糖、酒精。
[讲解] 电解质和非电解质都是化合物。电解质的导电条件是溶解于水或受热成熔化状态的二者之一;而非电解质虽溶解于水或受热熔化后,但都不导电。
实验证明:铜、铁等金属单质呈固态或熔化状态时都能导电;硫等非金属单质呈固态或熔化状态时也不导电。它们既不是电解质,也不是非电解质。
[提问] 以上两个实验中所试验的化合物如食盐、硝酸钾、氢氧化钠、磷酸等物质在干燥时不导电,而溶于水或熔化时却能导电、其原因是什么呢?
[引导分析]
电流——由带电微粒按一定方向移动而形成的。
能导电的物质——必须具有①能自由移动的②带电的微粒。
金属能导电——是由于金属中存在①能自由移动的②带负电的电子。
由上述可知:电解质如食盐(NaCl)的水溶液(或熔化成液体)能导电,一定存在着①能自由移动的,②带电荷的Na+、Cl-、(NaCl是离子化合物)、(当插入电极,连接直流电源时,Na+向阴极移动,Cl-向阳极移动,因而它能导电。
同理,可知其它电解质水溶液或熔化成液体能导电的原因,也是其中存在着能自由移动的带电的阴、阳离子。当这些电解质是干燥的固体,试管有带电的离子,但不能自由移动,因而也不能导电。
[讲解] 电解质如食盐(Na+与Cl-结合在一起的晶体)在溶解于水或受热熔化时,受水或加热的作用便产生自由移动的阴、阳离子。
[板书] 二、电解质的电离
电离:电解质溶解于水或受热熔化时,离解成自由移动离子的过程。
[设问] 怎样用化学语言来表达电离呢?
[板书] 下列电离方程式
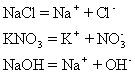
[讲解]
1.左边写电解质的化学式,右边写阴、阳离子符号,其间用“+”连接。
2.正价元素或原子团离解成阳离子,负价元素或原子团离解成阴离子。在电离过程中,原子团并不拆散。同时要求学生记住重要的根式和根价,![]()
3.在电离方程式中,离子的个数用阿拉伯数字标在离子符号前面。
4.离子所带电荷数等于元素或根的化合价数,但表示方法不同。
5.在电解质溶液里,所有阳离子带的正电荷总数和所有阴离子带的负电荷总数相等,所以,整个溶液不显电性。
[练习] 写出硫酸、氢氧化钙、氯化镁的电离方程式。(三个学生板演其余学生练习)
[讲评] MgCl2中的“2”,Mg2+中的“2”,Ca+2中的“2”,2Cl-中的“2”的意义不同。
(教师随时纠正错误)
[作业]
1.阅读课本本节有关电解质的电离的内容。
2.本节习题 略
教案说明
通过溶液的导电实验,推出电解质之所以在水溶液中或受热熔化能导电,必然存在能自由移动的带电微粒。故从现象到本质、从已知到未知逐步形成电离概念,从而发展了学生抽象思维和逻辑推理的能力。