 设为首页
设为首页
 加入收藏
加入收藏
关于教材引言的分析
本章引言虽只有一小段,但说明了:(1)本章学习酸、碱、盐等类物质的知识;(2)化合物种类繁多,如果按分类进行学习,就比较容易;(3)这几类物质在工农业生产、日常生活等方面有广泛应用(可举一简例说明)。通过引言的讲述,可以使学生初步知道本章学习的内容、方法和重要性,有利于调动他们学习的积极性。
学生在前七章的学习中实际上已经接触到一些酸、碱、盐和氧化物。在引言教学中可以让学生回忆一些他们熟悉的无机物的名称和化学式,教师可有目的地把学生回忆出来的化学式按酸、碱、盐、氧化物等几类在黑板上分别列出,以便最后归纳出如下的分类:
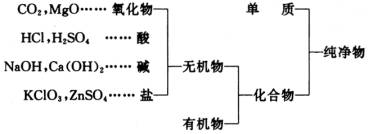
在此基础上可以向学生指出,无机物种类虽多,经过分类整理,可以发现它们也有一定规律,按照一定规律来学习,就可以化繁为简,化难为易,启发和调动学生学习的积极性。引言部分费时不可过多,即应转入第一节的学习。
本节从各种化合物的导电性实验引入,并以氯化钠为例,对它在溶于水时能够导电,而它的干燥晶体却不能导电的原因作了比较详细的分析,从而形成电离这个重要概念。这为下面学习酸、碱、盐的电离作好准备,同时也深化了学生对溶液的认识、教材还介绍了化合物电离的表示形式,即电离方程式。
通过化合物导电性的实验,提出了为什么有些物质在干燥时不能导电、溶于水时却可以导电的问题,为后面分析氯化钠、硝酸钾等物质在不同条件下(溶液、晶体)能否导电的原因提供了感性的认识,所以一定要把这个实验做好。实验时可先试氯化钠晶体。硝酸钾晶体、氢氧化钠晶体、蔗糖、酒精、蒸馏水等的导电性,结果灯泡都不发光。再把蒸馏水倒入氯化钠、硝酸钾、氢氧化钠、蔗糖和酒精中配成溶液,让学生观察到氯化钠、硝酸钾、氢氧化钠、磷酸溶液可以导电,而蔗糖、酒精溶液不导电。通过实验,使学生看到氯化钠、硝酸钾晶体不导电,而它们的溶液却能导电。这样容易激发学生的求知欲,引起他们的思考。
关于电离的教学建议
电离是一个较为重要的概念,教学时可按教材,先从氯化钠等晶体不导电,而它们溶于水却能导电的实验现象提出一系列问题。例如:金属为什么能导电?氯化钠晶体中钠和氢以什么微粒存在?氯化钠晶体中既然存在着带电的微粒,为什么不能导电?氯化钠溶于水,水溶液为什么能导电?引导学生从“电流是由带电微粒按一定方向移动而形成的”这一已知事实,展开逐题讨论(或由教师讲解),推论出氯化钠溶液既然能够导电,也必然存在能自由移动的带电微粒。再从氯化钠是由 ![]() 和
和 ![]() 组成的离子化合物推出它在晶体状态时,离子不能自由移动,
组成的离子化合物推出它在晶体状态时,离子不能自由移动,
溶于水时就能自由移动,因而也就能够导电。这样从现象到本质、从已知到未知逐步形成电离概念。从而发展了学生抽象思维和逻辑推理的能力。
关于电离方程式
讲述电离后,教学重点应该转移到书写电离方程式。
在书写电离方程式时,学生常犯的错误有:
(1)把原子团拆开。如:
![]()
(2)把离子所带电荷数标错或不标电荷。如:
![]()
(3)阴、阳离子的电荷总数的绝对值不相等。如
![]()
(4)两个以上相同离子应写成系数形式,却写成了右下角码。如:
![]()
(5)把离子的电荷数标成化合价。如:
![]()
为了防止学生发生上述错误,要在讲解和学生练习时讲清下述三个问题:
①正价元素或原子团离解成阳离子,负价元素或原子团离解成阴离子,在电离过程中,原子团并不拆散。
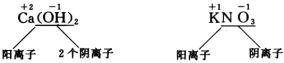
②离解发生在正价元素(或原子团)与负价元素(或原子团)两者接连处。
③元素或原子团的正价数等于形成的阳离子带的正电荷数,同理元素或原子团的负价数等于形成的阴离子带的负电荷数。离子的个数用阿拉伯数字标在离子符号之前。离子所带电荷数标在离子符号右上角,并且数字在前,“+”“-”号在后。
关于碱和盐的教学
碱和盐两部分教材的讲述,可按照讲酸的思路,演示实验后,或由老师讲述,或组织学生阅读教材后总结,或组织学生讨论后总结。无论采取什么样的途径在讨论碱的定义时也不可忽略“全部阴离子都是氢氧根离子”的“全部”二字。
有一个问题,在教学时,教师要心中有数,即有些物质不溶于水,但组成这种物质的阳离于是金属离子,阴离子全部是氢氧根离子,如 ![]() 、
、 ![]() 等也属于碱类,它们不易溶于水,所以不应该死套公式,写它们的电离方程式。这对以后讨论复分解反应时是很需要的。
等也属于碱类,它们不易溶于水,所以不应该死套公式,写它们的电离方程式。这对以后讨论复分解反应时是很需要的。
关于酸的教学
对酸概念的建立,教学时可按照教材的设计,先做演示实验证明盐酸、硫酸、硝酸的水溶液都能导电,然后让学生练习写出它们的电离方程式,目的是把学生思维的兴奋点从宏观现象引入微观境界中来,使他们在写出离子方程式的同时,想象到酸在水溶液中解离成自由移动的阴、阳离子的情景。
在书写酸电离方程式时,学生常出现的错误,一是标电荷与标化合价相混;一是经常忘掉氢离子前边的系数,致使电离出的氢离子数比酸根离子所带电荷数少,例如,常把硫酸的电离方程式错写成:![]()
纠正同学书写电离方程式的错误之后,引导同学分析三种酸的电离方程式的共同点(均能电离出 ![]() ),从而导出酸的定义。值得注意的是,一般由学生讨论所提出的酸的定义中,很难提到“全部阳离子都是氢离子”的“全部”两个字。因为学生还不知道酸式盐也能电离出氢离子。教师正好利用同学给出的定义中的欠缺,强调“全部”两个字的重要性,可以举出
),从而导出酸的定义。值得注意的是,一般由学生讨论所提出的酸的定义中,很难提到“全部阳离子都是氢离子”的“全部”两个字。因为学生还不知道酸式盐也能电离出氢离子。教师正好利用同学给出的定义中的欠缺,强调“全部”两个字的重要性,可以举出 ![]() 在水溶液中电离出来的阳离子并不全部是
在水溶液中电离出来的阳离子并不全部是 ![]() ,其中还有
,其中还有 ![]() ,而
,而 ![]() 不是酸,借以加深对酸定义的理解。
不是酸,借以加深对酸定义的理解。
关于酸碱盐概念的建立
在学生学习电离知识的基础上,从离子观点建立酸、碱、盐的概念。从离子观点对酸、碱、盐下定义,能使学生更本质地理解酸、碱、盐的组成。酸在水溶液里电离时生成的阳离子全部是氢离子;碱电离时生成的阴离子全部是氢氧根离子;盐是由金属离子和酸根离子组成的。
本节在讨论酸和碱时,只举强酸和强碱的例子。
演示实验建议
1、本节[实验8-1]内容多,演示时,要安排充分时间让学生把每一试剂名称、实验现象记录下来,以备讲电离时有足够的感性材料供思考。
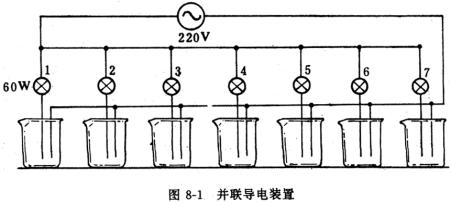
为了缩短演示实验的时间,又使学生便于记录和思考,可把试验物质的导电性装置做成图8-1并联导电装置。将氯化钠、氢氧化钠、硝酸钾、蔗糖晶体(晶体一定要干燥)、蒸馏水和酒精等分别放入小烧杯,把电极插入各烧杯里,一次便可测出这几种物质是否能导电。取出电极用差蒸馏水冲洗干净,然后往盛上述晶体和酒精的烧杯里倒入蒸馏水,配成溶液后,再插入电极测定溶液的导电性。
2、酸、碱、盐溶液的导电性实验,建议用下述浓度:盐酸用浓盐酸和水按体积比1:11配制,硝酸溶液用浓硝酸和水按体积比1:15配制,硫酸溶液用浓硫酸和水按体积比1:34配制。
氢氧化钾溶液用0.5摩/升(称2.8克氢氧化钾晶体用蒸馏水溶解后,再用蒸馏水稀释到100毫升);氢氧化钡用饱和溶液约0.2摩/升,如果没有氢氧化钡,可用氢氧化钙饱和溶液代替,它的浓度约0.02摩/升。
氯化钡溶液、碳酸钠溶液和硫酸镁溶液都可用20%的溶液。
实验电解质溶液导电性之前和之后,都要用蒸馏水冲洗电极。这不仅是本实验的需要,也是培养学生有一个良好操作习惯的需要。
3、实验酸、碱、盐溶液导电性时,为了节约时间,可用本书图8-1的并联测验物质导电性装置。酸作为一组、碱作为一组、盐作为一组,分三次完成。