 设为首页
设为首页
 加入收藏
加入收藏
扩展资料
电离度
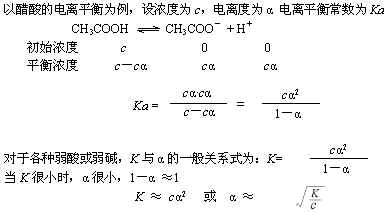
弱酸、弱碱等弱电解质在水溶液中存在电离平衡。例如:
![]()
![]()
![]()
![]()
![]()
![]()
当达到电离平衡时,弱电解质溶液里的离子浓度保持一定,可用此时离子浓度的高低衡量弱电解质的相对强弱。本节的电离度就是定量描述弱电解质强弱的重要概念。
1.准确理解电离度的概念
当弱电解质在溶液里达到电离平衡时,溶液中已经电离的电解质分子数占原来电解质总分子数的百分数叫电离度。电离度的符号用 ![]() 表示:
表示:
![]()
由于分子、离子等微观粒子的计数十分困难,使用不变,可把上式运用摩尔概念做以下变换:分子、分母各除以阿伏加德罗常数,把微粒数变为物质的量;再把分子、分母各除以溶液的体积,把弱电解质的物质的量变为物质的量浓度。此时,电离度表达式便成为下式:
![]()
对于一元弱酸而言
![]()
对于一元弱碱而言
![]()
这个把离子浓度、溶液浓度同电离度联系起来的表达式,对于理解和运用电离度的概念会有很大帮助。
多元弱酸、弱碱的电离是分步进行的,每步电离都存在相应的电离平衡。实验和理论计算证明,它们的二步电离度远远小于一步电离度,三步电离度又远远小于二步电离度。所以,多元弱酸溶液的氢离子浓度,多元弱碱溶液的氢氧根离子浓度,均可以近似以一步电离的离子浓度代替。
2.掌握影响电离度的因素
弱电解质的电离平衡是个动态平衡,同样服从平衡移动原理,这点必须明确。
(1)温度的影响 弱电解质的电离过程是吸热反应,按照平衡移动原理,升高温度,平衡向电离方向移动,电离度增大;降低温度,平衡向生成分子方向移动,电离度减小。
(2)浓度的影响 当溶液浓度下降时,有利于弱电解质分子变为自由水合离子,电离度增大;当溶液浓度升高时,有利于自由水合离子变为弱电解质分子,电离度减少。
当温度、浓度等外界条件一定时,该弱电解质的电离度为一常数,所以,可以用电离度的大小,表示弱电解质的相对强弱。
学习电离度概念要注意以下两点:
第一,区分好电离度和离子浓度。弱酸、弱碱溶液在稀释过程中,溶液浓度下降,电离度 ![]() 肯定增大,离子浓度不一定增大,离子浓度由溶液浓度
肯定增大,离子浓度不一定增大,离子浓度由溶液浓度 ![]() 与电离度
与电离度 ![]() 的乘积决定。
的乘积决定。
第二,区分好溶液浓度与离子浓度。在25℃时, ![]() 溶液的电离度为1%,离子浓度是0.01mol/L,溶液浓度是离子浓度的100倍。
溶液的电离度为1%,离子浓度是0.01mol/L,溶液浓度是离子浓度的100倍。 ![]() 溶液与Mg粉发生置换反应,研究反应速率要依据离子浓度,研究产物的质量则需依据溶液的浓度进行定量的计算,这是由于化学反应发生时,
溶液与Mg粉发生置换反应,研究反应速率要依据离子浓度,研究产物的质量则需依据溶液的浓度进行定量的计算,这是由于化学反应发生时, ![]() 电离平衡不断向正方向移动的缘故。
电离平衡不断向正方向移动的缘故。
扩展资料
电离度和电离平衡常数的关系
从化学平衡角度来看,电离平衡常数相当于化学平衡常数,只随温度的变化而变化;而电离度相当于化学平衡转化率,既随温度的变化而变化,又随浓度的变化而变化。
电离度(α)的大小与电离平衡常数(K)及浓度(c)有关,K越小,c越大,α就越小;反之,K越大,c越小,α就越大。
该公式的意义是:同一弱电解质的电离度与其浓度的平方根成正比,溶液浓度越稀,电离度越大;相同浓度的不同弱电解质的电离度与电离平衡常数的平方根成反比,电离平衡常数越大,电离度越小。这一规律被称为稀释定律。
将上述公式变形,即可得到计算一元弱酸溶液中c(H+)的简化公式:
c(H+) = ![]()
同样可以得到计算一元弱碱溶液中c(OH-)的简化公式:
c(H+) = ![]()
电离度小到什么程度时,才可以用简化公式计算c(H+)或c(OH-)呢?
根据稀释定律:K/c越小,则α越小,至于α小到什么程度才可以忽略已电离的酸的浓度,这要看人们对于计算结果的精确程度的要求而决定。一般情况下,当K/c≥500,则弱酸的电离度α小于5%,此时采用近似计算结果的相对误差约为2%,这就可以忽略电离的影响而采用近似公式计算。因此,我们一般就以K/c≥500作为近似计算的条件。
扩展资料
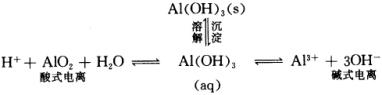
用电离平衡解释氢氧化铝的两性
氢氧化铝是一个典型的两性化合物,当与盐酸反应时,生成铝盐,表现出 ![]() 的碱性;当与
的碱性;当与 ![]() 反应时,生成偏铝酸盐,表现出
反应时,生成偏铝酸盐,表现出 ![]() 的酸性。这一反应的离子方程式为:
的酸性。这一反应的离子方程式为:
![]()
![]()
氢氧化铝为什么是典型的两性化合物呢?这是因为 ![]() 是一个难溶于水的弱电解质,在水溶液中存在溶解平衡和电离平衡,
是一个难溶于水的弱电解质,在水溶液中存在溶解平衡和电离平衡, ![]() 的电离存在酸式电离和碱式电离,
的电离存在酸式电离和碱式电离, ![]() 的溶解平衡和电离平衡可以表示如下:
的溶解平衡和电离平衡可以表示如下:
当在含有 ![]() 沉淀的饱和溶液中,加入强酸溶液时,强酸提供的
沉淀的饱和溶液中,加入强酸溶液时,强酸提供的 ![]() 与碱式平衡产生的
与碱式平衡产生的 ![]() 结合为
结合为 ![]() ,使
,使 ![]() 的电离平衡向碱式电离方向移动,
的电离平衡向碱式电离方向移动, ![]() 沉淀逐渐溶解并生成
沉淀逐渐溶解并生成 ![]() 。当在含有
。当在含有 ![]() 沉淀的饱和溶液中,加入强碱溶液时,强碱提供的
沉淀的饱和溶液中,加入强碱溶液时,强碱提供的 ![]() 与酸式电离产生的
与酸式电离产生的 ![]() 结合为
结合为 ![]() ,使溶液中的
,使溶液中的 ![]() 浓度下降,
浓度下降, ![]() 的电离平衡向酸式电离方向移动,此时,
的电离平衡向酸式电离方向移动,此时, ![]() 沉淀溶解并生成
沉淀溶解并生成 ![]() 。这样,运用
。这样,运用 ![]() 存在的酸式电离平衡和碱式电离平衡,及加入强酸、强碱溶液后
存在的酸式电离平衡和碱式电离平衡,及加入强酸、强碱溶液后 ![]() 电离平衡的移动,从理论上解释了
电离平衡的移动,从理论上解释了 ![]() 具有两性特点的原因。
具有两性特点的原因。
扩展资料
冰醋酸加水溶解过程中电离度和离子浓度的变化
冰醋酸即纯醋酸,它在液态时不电离,只以分子形式存在。当向一定量的冰醋酸中不断加入水时,醋酸的电离度随着醋酸浓度的减小而增大,但醋酸根离子和氢离子浓度的变化却呈先增大后减小的趋势(见下图)。
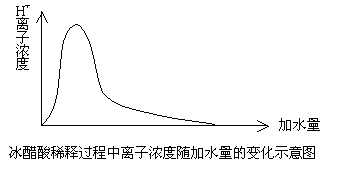
由图可见,开始加水后,原本以分子形式存在的醋酸开始电离,离子个数不断增多,离子浓度不断增大。当离子浓度达到最大值后,继续加水稀释,尽管电离程度仍在增大,电离产生的离子个数也仍在增多,但由于溶液体积增加的程度更大,使得离子的浓度呈下降趋势。
综上所述,对于冰醋酸或浓度很大的醋酸溶液,加水稀释时,电离度和离子浓度均逐渐增大。而对于稀醋酸溶液,继续加水稀释时,电离度逐渐增大,离子浓度逐渐减小。