 设为首页
设为首页
 加入收藏
加入收藏
典型例题
例1 能够充分说明在恒温恒容下的密闭容器中,反应
![]()
![]()
![]() 已达平衡状态的标志是( )。
已达平衡状态的标志是( )。
(A)容器中 ![]() 、
、 ![]() 、
、 ![]() 的物质的量之比为2:1:2
的物质的量之比为2:1:2
(B) ![]() 和
和 ![]() 的物质的量浓度相等
的物质的量浓度相等
(C)反应容器内压强不随时间变化而变化
(D)单位时间内生成 ![]() 时,即生成
时,即生成 ![]()
解析:由于题目中没有给出各物质的起始量,也没有给出反应的具体条件,所以无法知道容器中 ![]() 、
、 ![]() 、
、 ![]() 的物质的量之比为2:1:2时,及
的物质的量之比为2:1:2时,及 ![]() 、
、 ![]() 的物质的量浓度相等时反应是否达到平衡,也就是说无法知道达到平衡后,
的物质的量浓度相等时反应是否达到平衡,也就是说无法知道达到平衡后, ![]() 和
和 ![]() 的物质的量浓度上否相等。所以(A)、(B)选项不能选为答案。由于此反应是气体非等体积反应,在恒温恒容下,压强不变,说明各物质的浓度不变,故(C)选项正确。由于单位时间内生成
的物质的量浓度上否相等。所以(A)、(B)选项不能选为答案。由于此反应是气体非等体积反应,在恒温恒容下,压强不变,说明各物质的浓度不变,故(C)选项正确。由于单位时间内生成 ![]() 时,即消耗了
时,即消耗了 ![]() ,此时又生成
,此时又生成 ![]() ,即意味着正反应速率等于逆反应速率,所以(D)选项也正确。
,即意味着正反应速率等于逆反应速率,所以(D)选项也正确。
答案:(C)、(D)
例2 向氯化钙溶液中通入
![]() 气,看不到明显的反应,但向滴入氨水的氯化钙溶
气,看不到明显的反应,但向滴入氨水的氯化钙溶
液中通入 ![]() 气,则会看到有大量的白色沉淀产生,这是为什么?
气,则会看到有大量的白色沉淀产生,这是为什么?
解析:因为 ![]() 气在水中的溶解度不大,溶于水的
气在水中的溶解度不大,溶于水的 ![]() 气有少量与水反应,生成碳酸,碳酸只有微弱的电离,
气有少量与水反应,生成碳酸,碳酸只有微弱的电离, 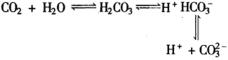 碳酸钙在水中存在溶解平衡,
碳酸钙在水中存在溶解平衡, ![]() (固)
(固) ![]()
![]() (溶)=
(溶)= ![]() 。在未加氯水的氯化钙溶液中通入
。在未加氯水的氯化钙溶液中通入 ![]() 气时,在溶液中产生的
气时,在溶液中产生的 ![]() 离子浓度很小,不足以和
离子浓度很小,不足以和 ![]() 结合生成沉淀。但在滴有氨水的氯化钙溶液中,因有
结合生成沉淀。但在滴有氨水的氯化钙溶液中,因有 ![]()
![]()
![]()
![]()
![]() 平衡,通入
平衡,通入 ![]() 气后形成的碳酸电离出的
气后形成的碳酸电离出的 ![]() 和
和 ![]() 结合生成极难电离的
结合生成极难电离的 ![]() ,使碳酸的电离平衡向正反应方向移动,溶液中的
,使碳酸的电离平衡向正反应方向移动,溶液中的 ![]() 离子浓度增大,
离子浓度增大, ![]() 离子浓度大于
离子浓度大于 ![]() 溶解平衡中电离出的
溶解平衡中电离出的 ![]() 离子浓度,使
离子浓度,使 ![]() 的溶解平衡向逆反应方向移动,因而便会看到有大量的白色沉淀(
的溶解平衡向逆反应方向移动,因而便会看到有大量的白色沉淀( ![]() )产生。
)产生。
例3 在合成氨工业中,原料气(
![]() 、
、 ![]() 及少量的
及少量的 ![]() 、
、 ![]() 的混合气)在进入合成塔前,常用乙酸二氨合铜(Ⅰ)溶液来吸收原料气中的
的混合气)在进入合成塔前,常用乙酸二氨合铜(Ⅰ)溶液来吸收原料气中的 ![]() ,其反应为:
,其反应为: ![]()
![]()
![]()
(1)必须除去原料气中 ![]() 的原因是什么?
的原因是什么?
(2)吸收 ![]() 的生产适宜条件是什么?
的生产适宜条件是什么?
(3)吸收 ![]() 后的乙酸铜氨液经过适当的处理后又可再生,恢复其吸收
后的乙酸铜氨液经过适当的处理后又可再生,恢复其吸收 ![]() 的能力,以供循环使用,再生的适宜条件是什么?
的能力,以供循环使用,再生的适宜条件是什么?
解析:(1)催化剂的催化专一性很强, ![]() 可使催化剂中毒,失去催化作用。为了防止催化剂中毒,故在原料气进入合成塔前必须除去原料气中的
可使催化剂中毒,失去催化作用。为了防止催化剂中毒,故在原料气进入合成塔前必须除去原料气中的 ![]() 。
。
(2)由题目给出的反应式知,吸收 ![]() 的反应是个可逆反应,其反应特点是正反应是气体体积缩小的放热反应,依据勒沙特列原理,吸收
的反应是个可逆反应,其反应特点是正反应是气体体积缩小的放热反应,依据勒沙特列原理,吸收 ![]() 的适宜条件是在适当温度下加压,
既使其反应有较大的速率,又使平衡向正反应方向移动。
的适宜条件是在适当温度下加压,
既使其反应有较大的速率,又使平衡向正反应方向移动。
(3)由题给方程知,其逆反应是个气体体积增大的吸热反应,依据平衡移动原理,再生的适宜条件应是在高温、低压下进行,使平衡向左移动。
例4 ![]()
![]()
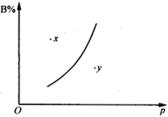
![]() (正反应为吸热反应)的可逆反应中,在恒温条件下,B的体积分数B%与压强(
(正反应为吸热反应)的可逆反应中,在恒温条件下,B的体积分数B%与压强( ![]() )关系如图所示。有关叙述正确的是( )
)关系如图所示。有关叙述正确的是( )
A. ![]() B.
B. ![]()
C. ![]() 点,
点, ![]() ,
, ![]() 点,
点, ![]()
D. ![]() 点比
点比 ![]() 点反应速率慢
点反应速率慢
分析:图中的曲线表示一定温度下反应物B的体积分数B%与压强之间的平衡线。且B%随着压强的增大而增大的反应,则
![]() 。因A为固体,故A、B均被排除。图中
。因A为固体,故A、B均被排除。图中 ![]() 点的B%高于该条件下平衡时的B%,此时反应要向B%减的方向移动,即反应正向移动,故
点的B%高于该条件下平衡时的B%,此时反应要向B%减的方向移动,即反应正向移动,故
![]() ,同理,
,同理, ![]() 点时
点时 ![]() 。又知在同样反应体系中,当温度一定时,压强越大,反应速率就越快,所以
。又知在同样反应体系中,当温度一定时,压强越大,反应速率就越快,所以 ![]() 点的反应速率大于
点的反应速率大于 ![]() 点的反应速率。
点的反应速率。
解:C、D选项符合题意。
点评:本题通过图象综合考查了对化学平衡概念的理解和运用,解题时应充分应用平衡移动原理来思考。