设为首页
设为首页
 加入收藏
加入收藏
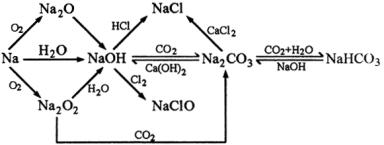
课题:钠的化合物
重点:碳酸钠与碳酸氢钠的性质及其鉴别方法
难点:过氧化钠与二氧化碳的反应
教学过程
[提问]钠与非金属反应,如 ![]() 、
、 ![]() 、
、 ![]() 等分别生成什么物质?而引入新课
等分别生成什么物质?而引入新课
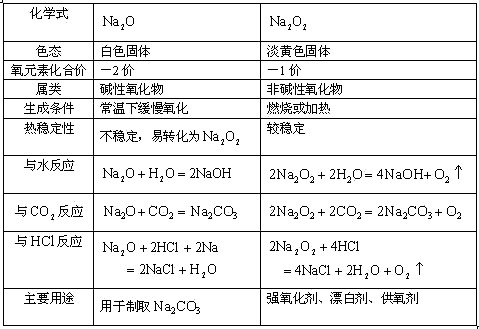
1.钠的氧化物
(1)展示 ![]() 、
、 ![]() 样品,让学生观察后总结出二者的物理性质。
样品,让学生观察后总结出二者的物理性质。
(2)演示课本第32页[实验2一5]把水滴入盛有 ![]() 、
、 ![]() 固体的两只试管中,用带火星的木条放在试管口,检验生成气体(图2-6)。
固体的两只试管中,用带火星的木条放在试管口,检验生成气体(图2-6)。
演示[实验 2-6]用棉花包住约
![]() 粉末,放在石棉网上,在棉花上滴加几滴水(图2-7)。观察发生的现象。让学生通过观察现象分析出钠的氧化物的化学性质。
粉末,放在石棉网上,在棉花上滴加几滴水(图2-7)。观察发生的现象。让学生通过观察现象分析出钠的氧化物的化学性质。
① ![]() 、
、 ![]() 与水反应
与水反应
![]() (放出氧气)
(放出氧气)
![]() (不放出氧气)
(不放出氧气)
② ![]() 、
、 ![]() 与
与 ![]() 作用
作用
![]() (放出氧气)
(放出氧气)
![]() (不放出氧气)
(不放出氧气)
[讨论]
① ![]() 是否是碱性氧化物
是否是碱性氧化物
② ![]() 是否是强氧化剂
是否是强氧化剂
学生根据所学知识可得出结论: ![]() 与水作用除生成
与水作用除生成 ![]() 还有氧气生成,与二氧化碳反应除生成
还有氧气生成,与二氧化碳反应除生成 ![]() 外也还有氧气,所以
外也还有氧气,所以 ![]() 不是碱性氧化物,由于与某些物质作用产生氧气,所以是强氧化剂。
不是碱性氧化物,由于与某些物质作用产生氧气,所以是强氧化剂。
[补充实验] ![]() 溶于水后
溶于水后
①作有色织物的漂白实验,有色织物褪色。
②将酚酞试液滴入该溶液,酚酞开始变红,又很快褪色。
[结论]过氧化钠有漂白作用,本质是发生了氧化还原反应。
(3)指导学生阅读课文了解 ![]() 的用途
的用途
授课过程中始终要求对比的形式进行比较氧化物的联系与区别
2.钠的其他重要化合物
碳酸钠和碳酸氢钠
①展示 ![]() 样品,做溶解性实验。
样品,做溶解性实验。
演示实验第32页[实验2-7][实验2-8]
a. ![]() 与盐酸反应,比较反应速率快慢
与盐酸反应,比较反应速率快慢
b. ![]() 、CO的热稳定性实验
、CO的热稳定性实验
通过观察到的现象,将二者的性质总结列表。
②让学生回忆将过量 ![]() 通入澄清石灰水时的反应现象及有关化学方程式:
通入澄清石灰水时的反应现象及有关化学方程式:
![]()
[提问]:当碳酸钠和碳酸氢钠外因条件变化时,二者可否相互转化?
提示 ![]() 也具有和
也具有和 ![]() 相似的性质:
相似的性质:
![]()
碳酸氢钠也具有 ![]() 相似的性质:
相似的性质:
![]()
![]()
![]()
![]()
有关离子方程式: ![]()
![]()
[结论]
![]() 既碳酸盐和碳酸氢盐的转化,本质就是酸根离子中“
既碳酸盐和碳酸氢盐的转化,本质就是酸根离子中“
![]() ”的变化。
”的变化。
③“侯氏制碱法”及碳酸钠、碳酸氢钠存在、制取用途等可由学生阅读课文后总结得出。
总结、扩展:
(1)总结
通过列表对比学习:钠的氧化物;碳酸钠和碳酸氢钠;以及连线法表示钠及其重要化合物的相互转化,可使学生更直观地掌握元素、化合物知识,及用对立统一的辩证唯物主义观点掌握物质之间的相互转化关系。
(2)扩展
根据 ![]() 的性质可知
的性质可知 ![]() 与
与 ![]() 反应,则可增加可燃烧气体(如
反应,则可增加可燃烧气体(如 ![]() 、
、 ![]() 、
、 ![]() ……)与
……)与 ![]() 共存于密闭容器,电火花点燃时反应以及酸式碳酸盐与
共存于密闭容器,电火花点燃时反应以及酸式碳酸盐与 ![]() 共热时的反应,培养学生的发散思维能力。
共热时的反应,培养学生的发散思维能力。
根据 ![]() 和
和 ![]() 的相互转化,不仅可掌握碳酸盐、碳酸氢盐相互转化的一般规律,同时要指出
的相互转化,不仅可掌握碳酸盐、碳酸氢盐相互转化的一般规律,同时要指出 ![]() 和
和 ![]() 在固态时和溶液中要用不同的检验方法,在固态时,可用加热法,在溶液中则需选用
在固态时和溶液中要用不同的检验方法,在固态时,可用加热法,在溶液中则需选用 ![]() 溶液和
溶液和 ![]() 溶液,而决不能用
溶液,而决不能用 ![]() 溶液或
溶液或 ![]() 溶液。
溶液。
布置作业:
1.补充作业
(1)向饱和 ![]() 溶液中通过量的
溶液中通过量的 ![]() 的现象及原因是什么?
的现象及原因是什么?
(2)有一部分被氧化的钠块(氧化部分生成 ![]() 和
和 ![]() )5g,与水完全反应,生成气体1.12L(标准状况),将这些气体引燃后冷却到标准状况,剩余气体为0.0336L,求钠块中单质钠、氧化钠、过氧化钠各多少克?
)5g,与水完全反应,生成气体1.12L(标准状况),将这些气体引燃后冷却到标准状况,剩余气体为0.0336L,求钠块中单质钠、氧化钠、过氧化钠各多少克?
(3)由 ![]() 与
与 ![]() 组成的混合物28.2g,放入坩埚中充分加热至质量不变时,将残留固体用足量的盐酸溶解可产生标准状况的气体3.36L;若将28.2g原混合物与盐酸反应则放出标准状况下气体4.48L,由此计算:①残留固体质量,②n值,③
组成的混合物28.2g,放入坩埚中充分加热至质量不变时,将残留固体用足量的盐酸溶解可产生标准状况的气体3.36L;若将28.2g原混合物与盐酸反应则放出标准状况下气体4.48L,由此计算:①残留固体质量,②n值,③ ![]() 质量
质量
(4)今向100g 8%的 ![]() 溶液中通入
溶液中通入 ![]() ,生成的盐的质量为13.7g时,通入多少克
,生成的盐的质量为13.7g时,通入多少克 ![]() ?
?
(5)200℃时,11.6g
![]() 和
和 ![]() 的混合气体与足量
的混合气体与足量 ![]() 充分反应后,固体质量增加3.6g,求混合气体的平均分子量。
充分反应后,固体质量增加3.6g,求混合气体的平均分子量。
2.教材有关习题
参考答案:
(1)现象:产生白色沉淀
原因:①溶解度: ![]()
②溶质的质量: ![]()
![]()
③溶剂:反应消耗水,使溶剂减少
(2) ![]()
![]()
![]()
(3)①15.9g
② ![]() ③
③ ![]()
(4)6.6g
(5) ![]()
板书设计:
第二节 钠的化合物
(一)钠的氧化物
(二)钠与盐(碳酸钠与碳酸氢钠的比较)

(三)[小结]:Na及其化合物的相互关系