 设为首页
设为首页
 加入收藏
加入收藏
一、教学依据:
现行人民教育出版社出版选修4《化学反应原理》之《化学反应速率》。
二、教学设计思路
教学环节 活动内容
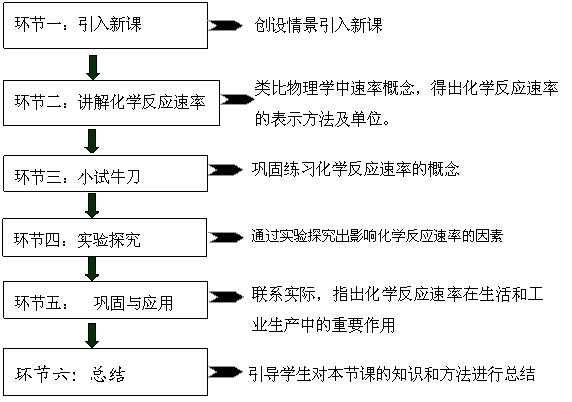 |
本节教学以体现教材编写意图为根本,努力营造“新课标化学课堂教学”研究氛围。化学反应速率内容的教学,应遵循由浅入深、从感性到理性的认识过程。注重引导学生从生活经验或对身边事物的观察为出发点,从生活中获取化学知识,认识到化学反应有快慢之分。通过探究实验来提升对影响化学反应速率因素的认识。
让学生讨论不同影响因素或者研究某一个因素对不同化学反应的影响。重点归纳出物质本身的性质、浓度、温度、固体的表面积、催化剂对反应速率的影响。
三、三维目标设计
I、知识与技能
(1)初步认识化学反应速率的概念,知道影响化学反应速率的因素,
(2)了解控制化学反应速率对人类的意义,并能解释有关现象
II、过程与方法
(1)通过探究影响化学反应速率的因素,使学生进一步熟悉实验探究的一般过程,同时培养学生观察能力、思维能力和实验能力
(2)在实验探究的过程中,引导学生体会定性观察、对比实验、控制变量等科学方法
III、情感态度与价值观
(1)引导学生关注生活,从生活中学习化学知识,再将化学知识应用于生产、生活实践的意识。
(2)通过分组实验,激发学生学习化学的兴趣,培养合作学习的意识,并体会实验对学习化学的重要性。
四、教学重点、难点
重点: 1、化学反应速率的概念。
2、化学反应速率受浓度、温度、压强、催化剂等因素的影响。
难点:影响化学反应速率的因素
五、教学方式
探究式合作学习
六、课时安排
1课时
七、教学准备
1、实验器材
(1)仪器:试管、胶头滴管、药匙、气球
(2)试剂:液体:5%H2O2溶液、HCl溶液(1 mol/L、0.1 mol/L)、洗涤剂
固体:MnO2粉末、CaCO3(块状、粉末)
2、教学资料,教学课件
八、教学过程
|
教学环节 |
教师活动 |
学生活动 |
设计 意图 | |||||||
|
新 课 引 入
|
【回 忆】 |
实验室制二氧化碳的原理: CaCO3+2HAC=CaAC2+H20+CO2↑ |
|
从学生熟悉的实验着手重现化学反应有快慢之分 | ||||||
|
【设 疑】 |
大理石和相同浓度的稀盐酸和醋酸反应的现象有什么不同? |
| ||||||||
|
【实 验】 |
在两支装有少量大理石的试管里,分别加入10 mL 1 mol/L盐酸和10 mL 1 mol/L醋酸,观察现象。 |
观察 描述 现象 | ||||||||
|
【现 象】 |
| |||||||||
|
【投影】 【思考】 |
你了解下列化学变化过程(爆炸、溶洞的形成、铁生锈、牛奶变质)进行的快慢吗?反应的快慢与我们有什么关系? |
思考回答 |
| |||||||
|
【小结】 |
化学反应的快慢对我们很重要,不同的反应我们希望它进行的快慢程度也不相同。 |
|
| |||||||
|
【引入新课】
|
选择的参照物不一样,反应快慢描述也不一样。如铁生锈相对煤的形成是快的反应,但相对氢气的爆炸是慢的反应。所以我们需要定量来描述化学反应的快慢,这就是今天我们要学习的化学反应速率。 |
思考回答 |
| |||||||
|
创 设 情 景 |
【投影】
|
“快慢”这个词在平时生活中也经常说起,比如:刘翔跑的很快,蜗牛爬的很慢,我们是用什么术语来描述“快慢”的? |
思考回答 |
从情景中体会化学反应快慢对我们的重要性 | ||||||
|
【思考】 |
物理学中用“速率”来表示物体运动的快慢,该用什么来表示一个化学反应进行的快慢呢? |
思考回答 |
培养学生知识迁移的能力 | |||||||
|
讲
解
化
学
反
应
速
率
|
【提问】
|
你能仿照物理学中“速率”的定义,给“化学反应速率”下个定义吗? | ||||||||
|
【板书】
|
第一节 化学反应的速率 一、化学反应的速率 2、表示:通常用单位时间里反应物浓度的减少或生成物浓度的增加来表示。 3、表达式: |
|
| |||||||
|
【思考】 |
根据化学反应速率的定义,你能分析出它的单位该怎么表示吗? |
推导 |
| |||||||
|
【板书】 |
4、单位:mol/(L·min)或mol/(L·s) |
|
| |||||||
|
【小结】
|
(1)化学反应速率是标量,即只有大小而没有方向; (2)化学反应速率实际上指的是某物质在某一段时间内化学反应的平均速率,而不是某一时刻的瞬时速率; (3)同一反应用不同物质表示的化学反应速率数值可能不同,但表示的意义是相同的,而且必须注明反应物质; (4)对于有纯液体或固体参与的化学反应一般不用纯液体或固体来表示化学反应速率,它们不存在浓度的改变; (5)同一化学反应中各物质的反应速率之比等于反应方程式中化学计量数之比。例如:N2 + 3H2 = 2NH3 中ν(N2):ν(H2):ν(NH3)=1:3:2 |
归纳 总结 |
培养学生归纳能力 | |||||||
|
小 试 牛 刀 |
【投影】
【练习】 |
1、某一反应物的浓度是2 mol.L-1,经过2min的反应,它的浓度变成了1.6 mol.L-1,求该反应的反应速率。 解:根据公式得
|
思考 作答 |
巩固 概念 | ||||||
|
【投影】
【练习】
|
2.在2 L的密闭容器中,加入1 mol N2和3 mol H2,发生 N2 + 3H2 = 2NH3 ,在2 s末时,测得容器中含有0.4 mol的NH3,求该反应的ν(NH3)、 ν(N2)、 ν(H2)。
解: N2 + 3H2 = 2NH3 起始量:0.5 mol· L-1 1.5 mol·L-1 0 2s末时: 0.2 mol· L-1 变化的量 反应中物质的变化量之比=化学化学反应速率之比=化学计量数之比如:
|
思考 作答
|
巩固 概念 | |||||||
|
实 验 探 究
|
【过渡】
|
化学反应速率与我们的生活是息息相关的,我们总希望对我们有利的反应越快越好,而对我们不利的反应则越慢越好!哪些因素会影响化学反应速率呢? |
|
| ||||||
|
【板书】 |
二.影响化学反应速率的因素 |
|
| |||||||
|
【思考】 |
在相同条件下,钠和镁同时与水反应,谁反应的更快?为什么? |
思考回答 |
培养学生分析能力 | |||||||
|
【板书】 |
(1)内因:物质本身的性质(决定性) |
|
| |||||||
|
【实验】 |
探究出影响化学反应速率的因素:温度、压强、浓度、催化剂等。 【实验2-2】在两支放有少量大理石的试管里,分别加入少量10 mL 1 mol/L盐酸和10 mL 0.1 mol/L盐酸。观察现象,然后给加10 mL 0.1mol/L盐酸的试管加热。观察现象。 |
学生动 手实验 |
培养学生实验能力 | |||||||
|
【现象】 |
1.大理石和1 mol/L盐酸迅速反应,有大量气泡产生,而加0.1 mol/L盐酸的试管里反应则比较缓慢。 2.当给加0.1 mol/L盐酸的试管里加热时,气泡的量增多,反应加快。 |
描述现象 |
| |||||||
|
【结论】 |
1、浓度对化学反应速率有很大影响,且浓度越大化学反应速率越快; 2、温度对化学反应速率有很大影响,且温度越大化学反应速率越快。 |
归纳 |
| |||||||
|
【实验2-3】 |
在两支放有少量大理石的试管里,分别加入少量5 mL 5%的H202溶液和三滴洗涤剂,再向其中一支试管中加少量MnO2粉末。观察反应现象。 |
学生动 手实验 |
培养学生实验能力 | |||||||
|
【现象】 |
在H202溶液中加MnO2粉末时立即有大量气泡产生,而在没有加MnO2粉末的试管中只有少量气泡出现。 |
描述现象 |
| |||||||
|
【结论】 |
催化剂MnO2使在H202溶液分解加快 |
归纳 |
| |||||||
|
【板书】 |
(2)外因:温度、浓度、催化剂、固体的表面积、物质的状态等 ①c增大,v增大; ②催化剂一般加快; |
|
| |||||||
|
【讲解】 |
对气体来说增大压强的目的是增加它的浓度,故压强也是影响化学反应速率的一大因素。阅读P36教材。 |
|
| |||||||
|
巩固与 应 用 |
【讲述】 |
知道了影响化学反应速率有哪些因素,我们可以通过调节这些因素来调控化学反应的速率。 |
|
让学生体会与社会、生活有密切的关系 | ||||||
|
【提问】
|
我们经常把食品保存在冰箱里,这是为什么? 还有在生产中,要想让庄稼生长的更好需要化肥,对于合成氨的反应,你有什么方法来加快生成NH3的速率? |
思考作答 | ||||||||
|
【讲述】 |
化学反应速率在生产和生活中的重要意义。 |
| ||||||||
|
总 结 |
【总结】
|
通过今天的学习,我们又从一个新的角度再次认识了化学反应:除了伴随物质变化和能量变化外,化学反应还有快慢的问题。对于化学反应的描述远不止这几个方面,我们将在以后的学习中继续学习。 |
归纳总结 |
培养学生归纳能力 | ||||||
九 、教学反思
本节课由浅入深,从学生已有的日常经验和化学常识中抽象出有关概念和原理。形成由简单到复杂、由宏观到微观、由感性到理性的科学探究过程。
通过对浓度和催化剂对化学反应速率影响的探究,加强学生实验探究能力,培养学生实验操作能力和语言表达能力。同时通过催化剂的教学,激发学生学习化学的兴趣。
学生自己动手对自己的推测进行验证,提高了学生的学习兴趣,而且掌握了知识,非常好。对于实验,考虑到时间的关系,每个小组真正能做的实验最多两个,所以很多结论所依据的实验现象学生并不能亲眼看到,也只能相信别人的结论,而少了自主论证的过程,如何来解决这一矛盾呢?这值得我们思考,在今后的教学中再不断的改进,争取更好的教学效果。
对拓展的“同一化学反应中各反应物和生成物的化学反应速率之比与化学计量数的关系”这一知识点,我们这样认为,并不一定要在课堂上来完成,完全可以以一道练习的形式抛给学生让他们在课下进行思考,有兴趣的同学应该很快找出规律,这样既让拓展了他们的知识,有培养了他们独立思考的能力,用探究实验的方法得出结论可能对学生学习这部分知识效果会更好。
|